Söödalisandi loa taotlus ning uue erisöödamaterjali tootmise ja erisöödamaterjali uue kasutamisviisi taotlus ning taotluse menetlemise kord1
Vastu võetud 25.01.2005 nr 8
Määrus kehtestatakse «Söödaseaduse» (RT I 2002, 18, 97; 63, 387; 2003, 48, 340; 88, 591; 2004, 34, 236) § 7 lõike 5 alusel.
§1. Reguleerimisala
Määrusega kehtestatakse:
1) Euroopa Parlamendi ja EL
Nõukogu määruse 1831/2003/EÜ loomasöötades kasutatavate söödalisandite
kohta (ELT L 268, 18.10.2003, lk 29–43) artiklis 17 nimetatud Ühenduse
söödalisandite registrisse kandmata söödalisandi (edaspidi uus
söödalisand) ringlusse lubamise eesmärgil tootmise loa
ning Ühenduse söödalisandite registrisse kantud söödalisandi uue
kasutamisviisi loa taotluse sisu- ja vorminõuded;
2)
põllumajandusministri 19. oktoobri 2004. a määruse nr 168
«Erisöödamaterjalide loetelu, nõuded erisöödamaterjali kasutamise ja
märgistamisel avaldatava teabe kohta1» (RTL 2004, 137,
2111) lisa (edaspidi erisöödamaterjalide loetelu) osa I
punktides 1 ja 2 nimetatud tooterühma kuuluva erisöödamaterjali, mis on
saadud mikroobide kasvatamisel ja mida ei ole nimetatud
erisöödamaterjalide loetelus (edaspidi uus erisöödamaterjal
), erisöödamaterjalide loetellu kandmiseks esitatava ning
erisöödamaterjalide loetelu osa I punktides 1 ja 2 nimetatud
erisöödamaterjali uue kasutamisviisi taotluse sisu- ja vorminõuded ning
taotluse esitamise ja menetlemise kord.
§2. Taotlus
(1) «Söödaseaduse» § 7 lõikes 3 nimetatud isik (edaspidi taotleja) esitab söödalisandi ringlusse lubamise eesmärgil tootmise loa või Ühenduse söödalisandite registrisse kantud söödalisandi uue kasutamisviisi loa taotlemiseks Euroopa Komisjonile lisa 1 vormi kohase taotluse.
(2) Lõikes 1 nimetatud taotlusega ühel ajal esitab taotleja Euroopa Toiduohutusametile lisa 3 vormile vastava toimiku.
(3) «Söödaseaduse» § 7 lõikes 4 nimetatud isik (edaspidi taotleja) esitab erisöödamaterjalide loetelu osa I punktides 1 ja 2 nimetatud tooterühma kuuluva uue erisöödamaterjali, mis on saadud mikroobide kasvatamisel, erisöödamaterjalide loetellu kandmiseks või erisöödamaterjalide loetelu osa I punktides 1 ja 2 nimetatud erisöödamaterjalile uue kasutamisviisi taotlemiseks Taimetoodangu Inspektsiooni kaudu Euroopa Komisjonile lisa 2 vormi kohase taotluse ja lisa 4 vormi kohase toimiku.
(4) Taotleja esitab lõikes 3 nimetatud taotluse ja toimikuga koos Taimetoodangu Inspektsioonile nende tõlke inglise, prantsuse või saksa keelde. Taimetoodangu Inspektsiooni nõusolekul ei pea taotleja esitama taotlust ja toimikut eesti keeles.
§3. Taotluse edastamise menetlus
(1) Taimetoodangu Inspektsioon otsustab uue erisöödamaterjali erisöödamaterjalide loetellu kandmise taotluse või erisöödamaterjalide loetellu kantud erisöödamaterjali uue kasutamisviisi taotluse edastamise Euroopa Komisjonile 30 tööpäeva jooksul arvates taotluse ja toimiku esitamisest.
(2) Lõikes 1 nimetatud otsuse tegemisel kontrollib Taimetoodangu Inspektsioon taotluses ja toimikus erisöödamaterjali kohta toodud andmete vastavust kehtestatud nõuetele.
(3) Taimetoodangu Inspektsioon ei edasta taotlust ja toimikut Euroopa
Komisjonile, kui nendes esitatud andmetest ei nähtu, et:
1)
erisöödamaterjalil on toiteväärtus lämmastiku- või valguallikana;
2)
erisöödamaterjal on nõuetekohasel kasutamisel ohutu inimese või looma
tervisele või keskkonnale;
3) erisöödamaterjali sisaldust söödas
on võimalik kontrollida.
(4) Kui Taimetoodangu Inspektsioonile esitatud taotlus või toimik ei vasta nõuetele või kui uue erisöödamaterjali või erisöödamaterjali uue kasutamisviisi vastavus lõikes 3 nimetatud nõuetele ei ole piisavalt tõendatud, määrab Taimetoodangu Inspektsioon puuduste kõrvaldamiseks tähtaja.
(5) Kui taotleja ei kõrvalda puudust määratud tähtpäevaks, jätab Taimetoodangu Inspektsioon taotluse läbi vaatamata ja tagastab saadud dokumendid.
(6) Kui Taimetoodangu Inspektsioon otsustab uue erisöödamaterjali erisöödamaterjalide loetellu kandmise taotluse või erisöödamaterjalide loetellu kantud erisöödamaterjali uue kasutamisviisi taotluse edastada Euroopa Komisjonile, saadab ta asjakohase taotluse ja toimiku ka teistele liikmesriikidele.
§4. Ärisaladus
(1) Taotleja võib nõuda, et toimikus sisalduvat teavet, mille avalikustamine võib taotlejat kahjustada, käsitatakse ärisaladusena.
(2) Ärisaladusena ei käsitata:
1) erisöödamaterjali
nimetust ja koostist ning teavet erisöödamaterjali tootmiseks kasutatava
kasvusubstraadi ja mikroorganismi kohta;
2) erisöödamaterjali
füüsikalis-keemilisi ja bioloogilisi omadusi;
3) teavet
erisöödamaterjali farmakoloogiliste, toksikoloogiliste ja
ökotoksikoloogiliste omaduste kohta;
4) analüüsimeetodeid, mida
kasutatakse erisöödamaterjali sisalduse kontrollimiseks sööda koostises.
§5. Lisaandmete nõudmine Euroopa Komisjoni poolt
(1) Kui Euroopa Komisjon või teine liikmesriik nõuavad Euroopa Komisjonile edastatud uue erisöödamaterjali erisöödamaterjalide loetellu kandmise taotluse või erisöödamaterjalide loetellu kantud erisöödamaterjali uue kasutamisviisi taotluse kohta lisaandmeid, edastab Taimetoodangu Inspektsioon nõude taotlejale, ning määrab andmete esitamise tähtaja.
(2) Taotleja esitab lisaandmed Taimetoodangu Inspektsioonile, kes
kontrollib nende nõuetekohasust ning edastab nõuetekohased andmed
Euroopa Komisjonile või teistele liikmesriikidele.
1
EÜ Nõukogu direktiiv 83/228/EMÜ teatavate loomasöötades kasutatavate
toodete hindamissuuniste kinnitamise kohta (EÜT L 126, 13.05.1983, lk
23–27); EÜ Nõukogu direktiiv 87/153/EMÜ, millega kinnitatakse
loomasöötades kasutatavate söödalisandite hindamissuunised (EÜT L 64,
07.03.1987, lk 19–28), muudetud direktiividega 94/40/EÜ (EÜT L 208,
11.08.1994, lk 15–26), 95/11/EÜ (EÜT L 106, 11.05.1995, lk 23–24) ja
2001/79/EÜ (EÜT L 267, 6.10.2001, lk 1–26)
| Minister Ester TUIKSOO |
| Kantsler Ants NOOT |
|
Põllumajandusministri 25. jaanuari 2005. a määruse
nr 8 «Söödalisandi loa taotlus ning uue erisöödamaterjali tootmise
ja erisöödamaterjali uue kasutamisviisi taotlus ning taotluse
menetlemise kord» lisa 1 |

| Kantsler Ants NOOT |
|
Põllumajandusministri 25. jaanuari 2005. a määruse
nr 8 «Söödalisandi loa taotlus ning uue erisöödamaterjali tootmise
ja erisöödamaterjali uue kasutamisviisi taotlus ning taotluse
menetlemise kord» lisa 2 |

| Kantsler Ants NOOT |
|
Põllumajandusministri 25. jaanuari 2005. a määruse
nr 8 «Söödalisandi loa taotlus ning uue erisöödamaterjali tootmise
ja erisöödamaterjali uue kasutamisviisi taotlus ning taotluse
menetlemise kord» lisa 3 |
SÖÖDALISANDI TOIMIKUTE VORMID
I. SÖÖDALISANDI TOIMIKU VORM, MIS KOOSTATAKSE SÖÖDALISANDI KOHTA, VÄLJA ARVATUD MIKROORGANISMID JA ENSÜÜMID
Üldosa
Söödalisandi toimikute abil peab olema võimalik söödalisandeid hinnata olemasolevate teadmiste alusel ning tagada, et söödalisandid vastavad nende lubamist käsitlevatele nõuetele.
Kui toimik koostatakse sellise söödalisandi kohta, mis koosneb geneetiliselt muundatud organismidest või sisaldab selliseid organisme, tuleb lisaks käesolevas lisas nõutavale teabele kanda toimikusse lisateave, mis on nõutav geneetiliselt muundatud organismide kasutamist reguleerivate õigusaktide alusel.
Toimik peab sisaldama kõikide tehtud uuringute üksikasjalikke aruandeid,
mis on esitatud käesolevas lisas toodud järjestuses. Toimik peab
sisaldama viiteid kõikidele söödalisandi hindamise seisukohast
olulistele avaldatud teaduslikele andmetele ning kõnealuste andmete
koopiaid. Toimiku elektrooniline versioon tuleb teha kättesaadavaks.
Uuringute eesmärk on näidata söödalisandi kasutamisohutust:
1)
sihtliikide suhtes kavandatud sisalduse puhul söödas;
2)
isikute suhtes, kes söödalisandi või seda sisaldavate eelsegude või
sööda käitlemisel võivad sellega kokku puutuda sissehingamise teel või
muu limaskesta, silmade või naha kaudu;
3) tarbijate suhtes, kes
söövad toiduaineid, mis on pärit söödalisandit saanud loomadelt ja
võivad sisaldada söödalisandi jääke või metaboliite; see ohutus
tagatakse tavaliselt jääkide piirnormide ja keeluaegade kehtestamisega;
4)
loomade ja inimeste suhtes mikroobivastaste ravimite resistentsusgeenide
valiku ja leviku tulemusena;
5) keskkonna suhtes otse söödalisandi
kaudu või sellest tuletatud saadustest otse või loomade poolt
väljutatuna.
Üldreeglina tuleb teha uuringud söödalisandi, selle kasutustingimuste, füüsikalis-keemiliste omaduste, määramismeetodite ja efektiivsuse kindlakstegemiseks, samuti tuleb teha uuringud, mis käsitlevad söödalisandi ainevahetust ja jääke ning selle füsioloogilist ja toksikoloogilist mõju sihtliikidele. Kui söödalisand on ette nähtud teatud liiki kuuluva määratletud loomarühma jaoks, tehakse efektiivsuse ja jääkide uuringud selle sihtrühmaga. Inimeste tervisele ja keskkonnale tekkiva ohu hindamiseks vajalikud uuringud sõltuvad peamiselt söödalisandi iseloomust ja selle kasutamise tingimustest.
Vajaduse korral tuleb esitada nõutav lisateave. Käesolevas lisas nõutud andmete väljajätmisel toimikust tuleb esitada põhjendused. Eelkõige mutageensuse, kantserogeensuse ja paljunemisvõimet mõjutava mürgisuse uuringud võib tegemata jätta üksnes juhul, kui söödalisandi keemilisest koostisest või praktilistest kogemustest tulenevalt või muudel kaalutlustel on võimalik kõnealust mõju mõistlikult välistada.
Esitada tuleb ekspertide aruanded söödalisandi kvaliteedi, efektiivsuse ja ohutuse kohta. Kõnealuste aruannete koostajad, kellel peab olema asjakohane kvalifikatsioon ja kes peavad olema asjaomases valdkonnas tunnustatud eksperdid, ei tohi olla isiklikult seotud toimikus kirjeldatud katsete tegemisega. Aruandes tuleb esitada taotleja esitatud dokumentide kriitiline hinnang, faktide kokkuvõte ei ole piisav.
Iga toimik peab sisaldama nõuetekohast kokkuvõtet ja ettepanekut lisa kohta ning võib sisaldada monograafiat.
Antibiootikume, koktsidiostaatikume ja muid raviaineid ning kasvustimulaatoreid käsitlevate toimikutega peab olema kaasas punktis 5 toodud vormile vastav monograafia.
Üksnes lemmikloomasöödaks ettenähtud söödalisandite puhul ei ole alati vaja rakendada nii põhjalikku kroonilise mürgisuse, mutageensuse ja kantserogeensuse uuringute programmi kui nende söödalisandite puhul, mis on ette nähtud kariloomadele, kellelt saadakse inimtoiduks ettenähtud saadusi. Lemmikloomade puhul ei nõuta uuringuid söödalisandite jääkide kohta.
Toidu tootmiseks peetavate sihtloomade ja mürgisuse uurimiseks laboris
kasutatavate loomaliikide puhul nõutakse söödalisandi ainevahetuse
uuringut eesmärgiga:
1) tagada piisavate andmete olemasolu
asjaomase söödalisandi ja nende metaboliitide mürgisuse kohta, mis
tekivad sihtliikides ja millega tarbija võib kokku puutuda. Selleks on
oluline võrrelda söödalisandi ainevahetust sihtliigi ja mürgisuse
uurimiseks kasutatavate laboriloomaliikide puhul;
2) teha kindlaks ja
kvantifitseerida asjakohane markerjääk või asjakohased markerjäägid,
mida kasutatakse markerjäägi piirnormi ja lõpptoote keeluaegade
kehtestamiseks.
Sisukord
1. Toimikus sisalduvate andmete kokkuvõte
2. Söödalisandi määratlus, omadused ja kasutustingimused;
kontrollimeetodid
2.1. Söödalisandi määratlus
2.2.
Toimeaine iseloomustus
2.3. Söödalisandi iseloomustus:
füüsikalis-keemilised ja tehnoloogilised omadused
2.4.
Söödalisandi kasutustingimused
2.5. Kontrollimeetodid
3. Söödalisandi efektiivsuse uuringud
3.1. Söödale avalduva
mõju uuringud
3.2. Loomadele avalduva mõju uuringud
3.3.
Loomsete saaduste kvaliteedi uuringud
3.4. Loomsetele jäätmetele
avalduva mõju uuringud
4. Söödalisandi kasutamisohutuse uuringud
4.1. Sihtliikide
uuringud
4.2. Katseloomade uuringud
4.3. Tarbija ohutuse hindamine
4.4.
Töötaja ohutuse hindamine
4.5. Keskkonnaohu hindamine
5. Monograafia vorm
5.1. Söödalisandi määratlus
5.2.
Toimeaine spetsifikatsioon
5.3. Söödalisandi füüsikalis-keemilised,
tehnoloogilised ja bioloogilised omadused
5.4. Kontrollimeetodid
5.5.
Söödalisandi bioloogilised omadused
5.6. Kvantitatiivsed ja
kvalitatiivsed andmed selliste võimalike jääkide kohta sihtkudedes, mis
leiduvad loomsetes saadustes pärast söödalisandi kasutamist kavandatud
viisil
5.7. Vajaduse korral tuleks esitada aktsepteeritav päevadoos,
kehtestatud jääkide piirnormid ja keeluajad
5.8. Muud
söödalisandi määratlemiseks asjakohased omadused
5.9.
Kasutustingimused
5.10. Kuupäev
6. Märgistuslehe vorm
7. Loa uuendamine söödalisandi puhul, mille luba on antud söödalisandi ringlusse laskmise eest vastutavale isikule
8. Uus taotleja, kelle taotlus tugineb esmakordsele loale söödalisandi puhul, mille luba on antud söödalisandi ringlusse laskmise eest vastutavale isikule
1. Toimikus sisalduvate andmete kokkuvõte
Kokkuvõttes tuleb järgida lisas esitatud järjekorda ja kõik osad tuleb varustada viidetega toimiku vastavatele lehekülgedele. Kokkuvõte peaks sisaldama ettepanekut kõikide taotletava loaga seotud tingimuste kohta.
2. Söödalisandi määratlus, omadused ja kasutustingimused; kontrollimeetodid
2.1. Söödalisandi määratlus
2.1.1. Kavandatav
müüginimetus või -nimetused
2.1.2. Söödalisandi tüüp
selle põhifunktsiooni järgi. Võimaluse korral tuleks lisada tõendid
toimeviisi kohta. Toimeaine kõik muud kasutusviisid tuleks täpsustada.
2.1.3.
Kvalitatiivne ja kvantitatiivne koostis (toimeaine, muud koostisained,
lisandid, varieerumine partiide kaupa). Kui toimeaine on aktiivsete
koostisosade segu, tuleb kõiki selgelt määratletavaid peamisi koostisosi
kirjeldada eraldi ning märkida nende osa segus.
2.1.4.
Füüsikaline olek, osakeste jaotus suuruse järgi, osakeste kuju, tihedus,
puistetihedus; vedelike puhul: viskoossus, pindpinevus.
2.1.5.
Tootmisprotsess, sealhulgas spetsiifilised töötlemismeetodid.
2.2. Toimeaine iseloomustus
2.2.1. Üldnimetus, keemiline nimetus
IUPACi (Rahvusvaheline Puhta Keemia ja Rakenduskeemia Liit)
nomenklatuuri järgi, muud rahvusvahelised üldnimetused ja lühendid. Chemical
Abstracts Service’i (CAS) number.
2.2.2. Struktuurivalem,
molekulivalem ja molekulmass.
Nende toimeainete puhul, mis on
käärimissaadused: mikroobne päritolu (rahvusvahelise
deponeerimisasutusena tunnustatud ja soovitatavalt Euroopa Ühenduses
asuva kultuuride kogu nimi ja asukoht, kus tüve säilitatakse;
registreerimisnumber ning kõik identifitseerimiseks vajalikud
morfoloogilised, füsioloogilised, geneetilised ja molekulaarsed
omadused). Geneetiliselt muundatud tüvede puhul tuleb esitada teave
geneetilise modifikatsiooni kohta.
2.2.3. Puhtus
Esinevate
keemiliste ja mikroobsete lisandite ning mürgiste ainete määratlus ja
kvantifikatsioon, kinnitus tootmiseks kasutatavate organismide puudumise
kohta.
2.2.4. Põhiomadused
Keemiliselt määratletud ainete
füüsikalised omadused: dissotsiatsioonikonstant, pKa, elektrostaatilised
omadused, sulamispunkt, keemispunkt, tihedus, aururõhk, lahustuvus vees
ja orgaanilistes lahustites, Kow ja Koc, massi- ja
neeldumisspekter, NMRi andmed, võimalikud isomeerid ja muud asjakohased
füüsikalised omadused.
2.2.5. Tootmis- ja
puhastusprotsessid, kasutatud kasvukeskkond ja käärimissaaduste puhul
varieerumine partiide kaupa.
2.3. Söödalisandi iseloomustus: füüsikalis-keemilised ja tehnoloogilised
omadused
2.3.1. Söödalisandi iga vormi stabiilsus kokkupuutel
keskkonnatingimustega nagu valgus, temperatuur, pH, niiskus, hapnik ja
pakkematerjal. Turustatava söödalisandi eeldatav säilivusaeg.
2.3.2.
Söödalisandi iga vormi stabiilsus eelsegude ja söötade valmistamisel ja
ladustamisel, eelkõige stabiilsus eeldatavate töötlemis- ja
ladustamistingimuste suhtes (kuumus, niiskus, surve- ja nihkejõud, aeg
ja pakkematerjal). Võimalikud lagunemissaadused. Söödalisandi eeldatav
säilivusaeg.
2.3.3. Muud füüsikalis-keemilised ja
tehnoloogilised omadused, mis on asjakohased homogeensete segude
moodustumisel ja püsimisel eelsegudes ja söötades, tolmuteket takistavad
ja elektrostaatilised omadused, hajuvus vedelikes.
2.3.4. Eeldatav
kokkusobimatus või vastasmõju söötade, tugiainete, muude heakskiidetud
söödalisandite või ravimitega.
2.4. Söödalisandi kasutustingimused
2.4.1. Kui söödalisand
omab nii olulist tehnoloogilist kui ka zootehnilist mõju, peab see
vastama mõlema väite kohta kehtestatud nõuetele. Iga söödalisandi kohta
esitatavad väited tuleb määratleda ja neid põhjendada.
2.4.2.
Kavandatav tehnoloogiline kasutusviis söödatootmises või vajaduse korral
toorainetes.
2.4.3. Kavandatav kasutusviis loomasöödas (nt
loomaliigid või -rühmad, loomade vanusegrupp/tootmisetapp, sööda liik,
vastunäidustused).
2.4.4. Eelsegudesse ja söötadesse või
vajaduse korral toorainetesse lisamise kavandatav viis ja lisatav kogus,
väljendatuna söödalisandi ja keemiliselt määratletud ainete
massiprotsendina eelsegudest, söötadest või vajaduse korral
toorainetest, ning kavandatav doos lõplikus söödas, manustamise kestus
ja vajaduse korral keeluaeg.
2.4.5. Tuleb esitada andmed toimeaine
muude teadaolevate kasutuste kohta (nt toidus, meditsiinis või
veterinaarias, põllumajanduses ja tööstuses).
2.4.6.
Kavandatav materjali ohutuskaart ning vajaduse korral kavandatavad
meetmed töökeskkonnariskide vältimiseks ja kaitsevahendid tootmise,
käitlemise, kasutamise ja kõrvaldamise ajaks.
2.5. Kontrollimeetodid
2.5.1. Punktides 2.1.3, 2.1.4, 2.2.3, 2.2.4,
2.3.1, 2.3.2, 2.3.3 ja 2.3.4 loetletud kriteeriumide kindlaksmääramiseks
kasutatavate meetodite kirjeldus.
2.5.2. Eelsegudes ja söötades
sisalduva toimeaine tavapäraseks kontrolliks kasutatavate
kvalitatiivsete ja kvantitatiivsete analüüsimeetodite kirjeldus.
Kõnealune meetod tuleb kinnitada vähemalt nelja labori vahelise võrdluse
põhjal või ettevõttesiseselt, järgides analüüsimeetodite ettevõttesisese
kinnitamise ühtseid rahvusvahelisi suuniseid järgmiste parameetrite
osas: kohaldatavus, selektiivsus, kalibreerimine, täpsus, korrektsus,
kohaldamisala, avastamispiir, kvantifitseerimispiir, tundlikkus,
stabiilsus ja otstarbekus. Tõendid nende omaduste hindamise kohta tuleb
teha kättesaadavaks (2.5.4).
2.5.3. Sihtkudedes ja loomsetes
saadustes sisalduva toimeaine markerjäägi kindlaksmääramise
kvalitatiivsete ja kvantitatiivsete analüüsimeetodite kirjeldus.
Markerjääk on jääk, mille kontsentratsioon on teadaolevas suhtes
kiirusega, millega kogujäägi kontsentratsioon sihtkoes väheneb jääkide
piirnormi tasemele.
2.5.4. Punktides 2.5.2 ja 2.5.3 nimetatud
meetoditele tuleks lisada teave kasutatava proovivõtumeetodi, saagise
protsendi, spetsiifilisuse, korrektsuse, täpsuse, avastamispiiride,
kvantifitseerimispiiride ja kasutatud kinnitamismenetluse korra kohta.
Toimeaine või markerjäägi võrdlusstandardid peavad olema kättesaadavad,
samuti teave kõnealuste võrdlusstandardite optimaalsete
säilitustingimuste kohta. Meetodite kavandamisel tuleb arvesse võtta
asjaolu, et meetodite kvantifitseerimispiirid peavad olema madalamad kui
jääkide piirnormid. Lisaks sellele tuleb arvesse võtta meetodite
sobivust tavapäraste analüüside tegemiseks.
3. Söödalisandi efektiivsuse uuringud
3.1. Söödale avalduva mõju uuringud
Kõnealused uuringud hõlmavad tehnoloogilisi lisandeid, nt antioksüdante, säilitusaineid, sideaineid, emulgaatoreid, stabilisaatoreid, želeerivad ained, pH modifitseerijaid jms, mis on ette nähtud eelsegude ja söötade omaduste parandamiseks või stabiliseerimiseks, kuid millel ei ole otsest bioloogilist mõju loomakasvatustoodangule. Kõiki väiteid söödalisandite mõju kohta tuleb põhjendada teaduslikult.
Tõendid söödalisandi efektiivsuse kohta tuleb esitada tunnustatud ja heakskiidetud meetodites kajastuvate asjakohaste kriteeriumide alusel, kavandatud kasutustingimustes ja võrdluses asjakohaste kontrollsöötadega. Kõnealused uuringud tuleb kavandada ja läbi viia nii, et oleks võimalik teha statistilist analüüsi.
Tuleks esitada täielik teave uuritavate toimeainete, preparaatide, eelsegude ja söötade kohta, samuti partiide viitenumbrite ning üksikasjalike töötlemis- ja katsetingimuste kohta. Iga katse puhul tuleks kirjeldada nii tehnoloogilist kui bioloogilist positiivset ja negatiivset mõju.
3.2. Loomadele avalduva mõju uuringud
Zootehniliste söödalisandite uuringud tuleb teha sihtliikide või -rühmadega, mille jaoks asjaomane söödalisand on ette nähtud, võrrelduna negatiivsete kontrollrühmadega (ilma antibiootikumide, kasvustimulaatorite ja muude raviaineteta) ning võimaluse korral võrrelduna rühmadega, kes saavad sööta, mis sisaldab teadaoleva mõjuga EL heakskiidetud söödalisandeid soovitatavates doosides (positiivsed kontrollrühmad).
Kasutatavad loomad peaksid olema terved ja soovitatavalt ühtlikust rühmast.
Uuringud peavad võimaldama hinnata söödalisandi efektiivsust vastavalt EL põllumajandustavale. Võimaluse korral tuleks samalaadseid uuringuplaane kasutada kõikide katsete puhul, et lõpuks oleks võimalik kontrollida andmete homogeensust ning koondada andmeid (kui testide tulemused seda lubavad) statistilise analüüsi tegemiseks.
Selleks et tagada paindlikkust ja teaduslikku diskretsiooni
uuringuplaanides ja uuringute läbiviimisel, ei soovitata ühtki
konkreetset plaani. Kasutatavat katseplaani tuleb põhjendada vastavalt
söödalisandi kasutamisega seotud väidetele ja selle puhul tuleb arvesse
võtta piisavat statistilist jõudu.
3.2.1.
Koktsidiostaatikumid ja muud raviained
Erilist tähelepanu tuleb
pöörata tõenditele spetsiifilise mõju kohta (nt tõrjutavad liigid, mõju
olelustsüklile või -tsüklitele) ja eelkõige profülaktilistele omadustele
(nt haigestumus, suremus, ootsüsti sisaldus ja kahjustuste ulatus).
Tuleks
esitada teave söödaväärindusele ja eluskaalu juurdekasvule avalduva mõju
kohta.
Nõutavad andmed efektiivsuse kohta hõlmavad sihtliikidega
tehtavate loomkatsete kolme etappi:
a) kontrollitavad puurikatsed
(üksik- ja segainfektsioon);
b) kontrollitavad uuringud
aedikutes (simuleeritud kasutustingimused);
c) kontrollitavad
välikatsed (tegelikud kasutustingimused).
Samal ajal ja vajaduse
korral efektiivsuse uuringute käigus tuleks registreerida täiendavaid
andmeid, et oleks võimalik hinnata kasvule ja söödaväärindusele
(nuumlinnud, asendus-haudekanad ja küülikud), munade viljastumisvõimele
ja kooruvusele (tõulinnud) avalduvat mõju.
3.2.2. Muud
zootehnilised söödalisandid
Tuleks esitada teave
söödakulule, eluskaalule, söödaväärindusele (eelistatult kuivaine
põhjal), saaduste kvaliteedile ja saagisele ning muudele loomade,
keskkonna, tootja või tarbija jaoks soodsatele parameetritele avalduva
mõju kohta. Vajaduse korral peaks uuringutes sisalduma doosi ja toime
suhe.
3.2.3. Katsetingimused
Katsed tuleks teha vähemalt kahes eri
kohas. Katsetest tuleks teada eraldi ning esitada üksikasjalikud andmed
kontrolli ja iga katse teostuse kohta. Hoolikalt koostatud uuringuplaan
peaks sisaldama kirjeldavaid üldandmeid järgmiste punktide kohta:
3.2.3.1.
Looma- või linnukari: asukoht ja suurus; söötmis- ja pidamistingimused,
söötmisviis; vees kasvatatavate liikide puhul põllumajandusettevõttes
asuvate basseinide või tiikide suurus ja arv ning vee kvaliteet.
3.2.3.2.
Loomad: liik (inimtoiduks ettenähtud vees kasvatatavate liikide puhul
kõnekeelne nimetus, millele lisatakse sulgudes ladinakeelne või Linné
nimetus), tõug, vanus, sugu, identifitseerimiskord, füsioloogiline
arenguetapp ja üldtervislik seisund.
3.2.3.3. Katse- ja
kontrollrühmade arv, loomade arv igas rühmas. Katsetes kasutatavate
loomade arv peab võimaldama statistilist analüüsi. Tuleks esitada
statistilise analüüsi meetodid. Väidetava mõju demonstreerimiseks tuleb
iga asjaomase loomarühma puhul teha vähemalt kolm võrreldavat eraldi
katset tasemel p0,05. Mäletsejaliste puhul võib lubada madalamat
tõenäosuse taset (p0,10). Aruandes tuleks esitada andmed kõikide
katsetes kasutatud loomade või katseühikute kohta. Teatada tuleks
juhtudest, mida ei ole võimalik hinnata andmete puudumise või kadumise
tõttu, ning liigitada need loomarühmade kaupa.
3.2.3.4.
Toit: toidu tootmise ja kvantitatiivse koostise kirjeldus: kasutatud
koostisained, asjaomased toitained (analüüsitud väärtused) ja energia.
Andmed söödakulu kohta.
3.2.3.5. Kontrollanalüüsi käigus
tuleks asjakohase tunnustatud meetodiga määrata toimeaine (ja vajaduse
korral võrdlusainete) kontsentratsioon söödas. Partiide viitenumbrid.
3.2.3.6.
Katsete kuupäev ja täpne kestus. Läbiviidud uuringute kuupäev ja laad.
3.2.3.7.
Doosi kindlaksmääramise uuringud: nende uuringute eesmärk on selgitada
optimaalselt tõhusaks peetava doosi või doosipiirkonna valikut. Doosi
kindlaksmääramisel võetakse aluseks kontrollrühm (ilma antibiootikumide,
kasvustimulaatorite ja muude raviaineteta) ja vähemalt kolm annust
sihtloomade puhul.
3.2.3.8. Teatada tuleb soovimatute tagajärgede
ilmnemise aeg ja levimus üksikloomade või loomarühmade puhul (esitada
üksikasjad uuringus kasutatava vaatlusprogrammi kohta).
3.2.3.9.
Kõikide söödalisandite puhul, mida uuritakse põllumajandusettevõtte
tingimustes, tuleb teaduslikult tõendada ohutust kasutaja, tarbija,
loomade ja keskkonna suhtes. Kui söödalisand ei vasta tarbijaohutuse
nõuetele, peaks läbiviidav uuring olema kavandatud nii, et on välistatud
katseloomadelt saadud loomsete saaduste sattumine inimeste toiduahelasse.
3.3. Loomsete saaduste kvaliteedi uuringud
Loomsete saaduste puhul tuleks vastavalt vajadusele uurida nende organoleptilisi omadusi, toiteväärtust, hügieeniomadusi ja tehnoloogilisi omadusi.
3.4. Loomsetele jäätmetele avalduva mõju uuringud
Kui söödalisand on ette nähtud loomsete jäätmete teatavate omaduste (nt lämmastiku- või fosforisisalduse, lõhna või koguse) muutmiseks, nõutakse uuringuid kõnealuse mõju demonstreerimiseks.
4. Söödalisandi kasutamisohutuse uuringud
Käesolevas jaos kirjeldatud uuringud on ette nähtud selleks, et hinnata:
1)
söödalisandi kasutamise ohutust sihtliikides;
2)
riske, mis on seotud antibiootikumide suhtes esineva resistentsuse
valiku või ülekandega ning enteropatogeenide suurenenud püsivuse ja
levikuga;
3) tarbijale tekkivaid ohte, mis võivad tuleneda
söödalisandi jääke või metaboliite sisaldava toidu tarbimisest;
4)
sissehingamisest või muul kokkupuutel limaskesta, silmade või nahaga
tekkivaid ohte isikutele, kes tõenäoliselt käitlevad söödalisandit
algolekus või eelsegude või söötade koostisosana;
5)
ohte seoses keskkonnale tekkivate kahjulike mõjudega, mis tulenevad otse
söödalisandist või sellest tuletatud saadustest otse või loomade poolt
väljutatuna.
Tuleks arvesse võtta teadaolevat kokkusobimatust või vastasmõju söödalisandite ja veterinaarravimite või asjaomase liigi puhul kasutatavate toidukomponentide vahel. Reeglina nõutakse neid uuringuid tervikuna iga söödalisandi puhul, välja arvatud juhul, kui direktiivis on sätestatud konkreetne erand või muudatus.
Piiratud taotlus võetakse vastu, kui söödalisandi lubatud kasutusviisi soovitakse laiendada sellisele loomaliigile, mille füsioloogia ja ainevahetus on samalaadne liigiga, kelle puhul asjaomase söödalisandi kasutamine on heaks kiidetud. Kõnealustest piiratud andmetest peab nähtuma ohutus uue liigi suhtes ning oluliste erinevuste puudumine ainevahetuse ja söödavates kudedes esinevate jääkide osas. Tuleb põhjendada kavandatavat jääkide piirnormi ja keeluaega asjaomase liigi puhul.
Tarbijale tekkivate ohtude hindamiseks ning jääkide piirnormide ja
keeluaja kindlaksmääramiseks tuleb esitada järgmine teave:
1)
toimeaine keemiline struktuur;
2) ainevahetus kavandatavate
sihtliikide puhul;
3) jääkide laad kõnealuste sihtliikide puhul;
4)
jääkide kudedest kadumise uuring;
5) andmed toimeaine ja
selle metaboliitide bioloogilise toime kohta.
Kasulik võib olla ka teave (nii vabade kui seotud) jääkide biosaadavuse kohta, eelkõige juhul, kui tekib palju metaboliite ja markerjääke ei esine. Lisaks sellele on vaja tunda asjaomasest söödalisandist tulenevate peamiste eritiste koostist ning füüsikalis-keemilisi ja bioloogilisi omadusi, et määrata kindlaks nende uuringute maht, mis on vajalikud selleks, et hinnata kõnealuste eritiste kahjulikku mõju keskkonnale või nende püsivust keskkonnas.
4.1. Sihtliikide uuringud
4.1.1. Sihtliikide ja -rühma taluvustestid
Eesmärk
on määrata kindlaks ohutusvahemik (s.o vahemik söötades sisalduva
kavandatava maksimumdoosi ja ebasoodsa toimega miinimumdoosi vahel).
Ohutusvahemikku koefitsiendiga vähemalt 10 käsitatakse piisavana ning
sel juhul ei nõuta edasisi teste. Kõnealune taluvustest tuleb
sihtliikide või -rühma puhul teha soovitatavalt kogu tootmisperioodi
jooksul, kuigi ühe kuu pikkune testimisaeg on tavaliselt vastuvõetav.
Selleks nõutakse vähemalt kliiniliste tunnuste ja muude parameetrite
hindamist, et teha kindlaks mõju sihtlooma tervisele. Testis peab
osalema ka negatiivne kontrollrühm (ilma antibiootikumide,
kasvustimulaatorite ja muude raviaineteta). Olenevalt toksikoloogilisest
profiilist võib nõuda täiendavaid parameetreid. Käesolevas jaos tuleks
teatada ka efektiivsuse uuringute ajal täheldatud kahjulikust mõjust.
Kui
toode on ette nähtud loomadele, keda võidakse kasutada aretuseks, tuleks
uuringute käigus teha kindlaks uuritava söödalisandi manustamisest
tulenev üldise paljunemisvõime võimalik halvenemine isas- või
emasloomadel või kahjulik mõju järglaskonnale.
4.1.2.
Söödalisandi mikrobioloogiline ohutus.
4.1.2.1. Kõik
uuringud tuleb teha kõrgeima kavandatud doosiga.
4.1.2.2. Kui
toimeainel on söödas esineva kontsentratsiooni puhul antimikroobne
toime, tuleks standarditud menetlusega määrata kindlaks asjaomaste
patogeensete ja mittepatogeensete endogeensete ja eksogeensete bakterite
minimaalne inhibeeriv kontsentratsioon.
4.1.2.3. Katsed, millega
määratakse kindlaks söödalisandi võime:
1)
tekitada ristresistentsust asjaomaste antibiootikumide suhtes;
2)
valida välitingimustes sihtliigi puhul resistentseid bakterite tüvesid,
selle võime esinemise korral tuleb teha resistentsusgeenide ülekande
geneetiliste mehhanismide uuringud.
4.1.2.4. Katsed, millega
määratakse kindlaks söödalisandi mõju:
1)
teatavatele seedetrakti oportunistlikele patogeenidele (nt
enterobakterid, enterokokid ja klostriidid);
2) asjaomaste
zoonoossete mikroorganismide, nt salmonella spp, campylobacter spp,
levikule või eritumisele.
4.1.2.5. Kui toimeaine on
antimikroobse toimega, tuleks teha väliuuringud söödalisandi suhtes
esineva bakteriaalse resistentsuse jälgimiseks.
4.1.3.
Ainevahetuse ja jääkide uuringud
4.1.3.1. Uuringute eesmärk
on:
1) teha kindlaks toimeaine ainevahetusrajad, mis on toimeaine
toksikoloogilise hindamise aluseks;
2) identifitseerida jäägid ja
määrata kindlaks nende kineetika söödavates kudedes ja saadustes (piim,
munad);
3) identifitseerida eritised, et hinnata nende mõju
keskkonnale.
Teatavatel juhtudel, näiteks kääritamise teel saadud
söödalisandite puhul, võib olla vajalik laiendada kõnealuseid uuringuid
muudele ainetele, mis on lisatud või saadud kääritamisprotsessi käigus.
Selline olukord tekib näiteks juhul, kui aine mürgisus võrreldes
söödalisandi aktiivse(te) koostisosa(de) mürgisusega on märkimisväärne.
4.1.3.2.
Farmakokineetika
Uuringute kavandamisel ja katseplaani koostamisel
tuleb arvesse võtta sihtpopulatsiooni anatoomilist, füsioloogilist
(vanus, liik, sugu) ja zootehnilist kategooriat ning keskkondlikke
eripärasid. Vajaduse korral tuleb arvesse võtta soolestiku või mao
mikrofloora, enterohepaatilise tsirkulatsiooni või tsekotroofia mõju.
Uurida tuleb kasutamiseks kavandatud doosi ja võimaluse korral ka
mitmekordset doosi, kui see on õigustatud. Toimeaine (kaasa arvatud
märgistatud toime aine) peab ol ema söödale lisatud, välja arvatud
juhul, kui lisamata jätmine on õigustatud.
Nõutakse
järgmisi uuringuid:
1) ainevahetuse tasakaal ja kineetika
vereplasmas/veres pärast ühekordse doosi manustamist, et hinnata
imendumist, jaotumist ja eritumist (uriin, fekaalid, lõpused, sapp,
väljahingatav õhk, piim, munad);
2) väljaheidetes
sisalduvate suure osakaaluga (>10%) metaboliitide identifitseerimine,
välja arvatud juhul, kui väikese osakaaluga (10%) metaboliit näib olevat
toksikoloogiliselt oluline;
3) märgistatud materjali jaotumine
kudedes ja saadustes pärast ühekordse doosi manustamist loomadele, kelle
puhul on saavutatud püsiv tasakaaluseisund märgistamata söödalisandiga.
Punktides 4.1.3.1 ja 4.1.3.2 nimetatud uuringud peaksid hõlmama
isotoopide märgistamist või alternatiivseid asjakohaseid meetodeid.
4.1.3.3.
Jääkide uuring
Nende jääkide (lähteaine, metaboliidid,
lagunemisproduktid, seotud jäägid) kindlakstegemine, mis moodustavad üle
10% kõikidest söödavates kudedes ja saadustes (piim, munad)
sisalduvatest jääkidest (välja arvatud juhul, kui väikese osakaaluga
metaboliit näib olevat toksikoloogiliselt oluline), ainevahetuse
tasakaalu juures, st pärast märgistatud aine mitme doosi manustamist;
markerjäägi ja jääkide üldkoguse suhe:
1)
kudedes (sh vajaduse korral piimas ja munades) esinevate jääkide
kineetiline analüüs jääkide kadumise ajal pärast püsiva seisundi
saavutamist ning kasutades suurimat kavandatud kogust, ainevahetuse
profiili koostamine, sihtkoe ja markerjäägi kindlakstegemine;
2)
markerjäägi sihtkudedest (sh vajaduse korral piimast ja munadest)
kadumise uuring söödalisandi manustamise lõpetamisel pärast korduvat
manustamist, mis on toimunud vastavalt kavandatud kasutustingimustele ja
olnud piisav püsiva seisundi saavutamiseks, et kehtestada keeluaeg
kindlaksmääratud jääkide piirnormi alusel;
3)
söödalisandi keeluaeg ei tohi olla lühem kui aeg, mis on vajalik
sihtkoes kindlaksmääratud markerjäägi kontsentratsiooni vähenemiseks
alla jääkide piirnormi (usalduspiir 95%). Miinimumnõuetena tuleks
käsitada toimeaine ja selle metaboliitide kadumisetapi põhjal sobivalt
valitud ajahetki ja sõltuvalt liigist (suurus, geneetiline varieeruvus)
vähemalt nelja looma ühe ajahetke kohta.
Seotud jäägid vastavad koe jäägifraktsioonile, mida ei ole võimalik ekstraheerida füüsikalis-keemiliste või bioloogiliste vahenditega. Seotud jäägid tulenevad ühendi metaboliidi kovalentsest seosest raku makromolekulidega. Sihtkude on söödav kude, mis on valitud kogujäägi jälgimiseks sihtloomas.
Keeluaja kindlaksmääramisel on iga tapmise ajal või igal ajahetkel
proovi võtmiseks valitud tervete loomade soovituslikud minimaalsed arvud
järgmised:
1) lakteerivad lehmad: 8, sh teise või järgmise
laktatsiooni loomad (4 suure piimajõudlusega looma laktatsiooni varases
etapis ja 4 väikse piimajõudlusega looma laktatsiooni hilises etapis);
2)
muud suured loomad: 4 iga proovivõtuaja kohta;
3) kodulinnud: 6
iga proovivõtuaja kohta;
4) munalinnud: 10 iga ajahetke kohta;
5)
kalad: 10 iga proovivõtuaja kohta.
4.2. Katseloomade uuringud
Need uuringud tuleb teha toimeainega, kasutades rahvusvaheliselt
tunnustatud standardseid katsemeetodeid, mida on kirjeldatud OECD
suunistes või EL Nõukogu direktiivis 67/548/EMÜ ohtlike ainete
klassifitseerimise, pakendamise ja märgistamise kohta (EÜT L 196,
16.08.1967, lk. 1–98), ning vastavalt hea laboritava põhimõtetele.
Teatavate sihtliikides tekkinud metaboliitide puhul võib olla vaja
täiendavaid uuringuid, kui need metaboliidid ei teki olulisel määral
katseloomaliikides. Inimestega seotud andmete puhul võib see teave olla
vajalik, et otsustada, milliseid täiendavaid uuringuid läbi viia.
4.2.1.
Äge mürgisus
Ägeda suukaudse mürgisuse uuringud tuleks teha
vähemalt kahe imetajate liigiga. Ühe katseloomaliigi võib vajaduse
korral asendada sihtliigiga. Täpse LD50
kindlaksmääramine ei ole vajalik; minimaalse surmava annuse ligikaudne
kindlaksmääramine on tavaliselt piisav. Katseloomade arvu ja kannatuste
vähendamiseks ei tohiks maksimaalne doos olla suurem kui 2000 mg
kehamassi kg kohta ning soovitatakse alternatiivseid meetodeid
(piirkatse, kindla annuse meetod, ägeda mürgisusastme meetod).
Töötajatele
tekkivaid ohte tuleks hinnata mitmete tootega tehtavate uuringute abil
(toimeaine ja tugiaine sellisel kujul, nagu see esitatakse müügiks).
Tuleks teha nahka ärritava toime uuringud ning kui tulemused on
positiivsed, tuleks hinnata limaskesta (nt silma) ärritavat toimet.
Tuleks hinnata allergia ja naha sensibiliseerimise võimalikkust. Kui
toode tekitab tõenäoliselt sissehingatavat tolmu või udu, tuleks teha
sissehingamisel tekkiva ägeda mürgisuse uuringud.
4.2.2.
Genotoksilisuse uuringud, sh mutageensus
Mutageensete ja
genotoksiliste omadustega toimeainete ja vajaduse korral nende
metaboliitide ja lagunemisproduktide kindlakstegemiseks tuleb teha
vähemalt kolm erinevat genotoksilisuse katset valitud kombinatsioonis.
Saritest peaks tavaliselt hõlmama prokarüootse ja eukarüootse süsteemi
katseid, samuti imetajate in vitro ja in vivo katsete
süsteeme. Vajaduse korral tuleks katsed teha nii ilma imetaja metaboolse
aktiveerimiseta kui ka koos sellega.
Katsete valikut tuleks
põhjendada, võttes arvesse nende usaldusväärsust erinevates geneetilise
toime avaldumise faasides tekkiva genotoksilise mõju hindamisel geeni,
kromosoomi ja genoomi tasandil. Sõltuvalt katsete tulemustest ning
võttes arvesse aine kogu mürgisuse profiili ja kavandatavat kasutust,
võib teha täiendavaid katseid. Katsed tuleb teha vastavalt tunnustatud,
ajakohastatud ja kinnitatud meetoditele. Kui katse tehakse luuüdiga,
tuleb negatiivse tulemuse korral esitada tõendid rakkude kokkupuute
kohta testainega.
4.2.3. Subkroonilise suukaudse mürgisuse
(90-päevased) uuringud
Katsete kestus peab olema vähemalt 90
päeva. Toiduloomade jaoks ettenähtud söödalisandite puhul tuleb uuringud
teha kahe loomaliigiga, millest üks peaks olema muu liik kui näriline,
näiteks sihtliik. Muude loomade kui toiduloomade jaoks ettenähtud
söödalisandite puhul piisab sihtliigiga tehtavatest uuringutest;
toimeainet tuleb doosile reageerimise saavutamiseks manustada suu kaudu
vähemalt kolmes erinevas koguses lisaks kontrollrühmale.
Maksimaalse
doosi puhul peaks tavaliselt avalduma kahjulik mõju. Väikseima doosi
puhul ei tohiks mürgisust ilmneda.
4.2.4. Suukaudse kroonilise
mürgisuse uuringud (sealhulgas kantserogeensuse uuringud)
Kroonilise
mürgisuse uuring, mis võib hõlmata ka kantserogeensuse uurimist, tuleb
teha vähemalt ühe näriliste liigiga. Kantserogeensuse uuringud võib
jätta tegemata, kui toimeaine ja selle metaboliidid:
1) annavad
piisava hulga genotoksilisuse katsete puhul järjekindlalt negatiivseid
tulemusi;
2) ei ole struktuuriliselt seotud teadaolevate
kantserogeenidega ja
3) ei anna kroonilise mürgisuse uuringutes
potentsiaalsele (pre)neoplaasiale osutavaid tulemusi.
4.2.5.
Paljunemisvõimet mõjutava mürgisuse (sealhulgas teratogeensuse) uuringud
4.2.5.1.
Paljunemisvõimet mõjutava mürgisuse uuring kahe põlvkonnaga
Paljunemisvõime
uuringud peavad hõlmama vähemalt kahte järglaspõlvkonda (F1, F2) ja need
võib kombineerida teratogeensuse uuringuga. Uuritavat ainet manustatakse
isas- ja emasloomadele sobival ajal enne paaritamist. Manustamist tuleks
jätkata F2-põlvkonna võõrutamiseni.
Viljakust,
tiinust, sünnitust, emalikku käitumist, imetamist, kasvu ja arengut F1
järeltulijate puhul viljastumisest kuni suguküpsuseni ja F2
järeltulijate puhul kuni võõrutamiseni tuleb hoolikalt jälgida ja
vastavad andmed registreerida.
4.2.5.2. Teratogeensuse uuring
Teratogeensuse
uuring hõlmab embrüot ja embrüotoksilisust. See uuring tuleb teha
vähemalt kahe liigiga.
4.2.6. Ainevahetuse ja jaotumise uuringud
Tuleb
uurida imendumist, kehavedelikes ja -kudedes jaotumist ning
eritumisteid. Ainevahetuse uuring, mis hõlmab ainevahetuse tasakaalu
ning uriinis ja fekaalides esinevate peamiste metaboliitide
kindlakstegemist, tuleks teha mõlemast soost loomadega ja samade
tüvedega, mida kasutati toksikoloogilistes uuringutes. Märgistatud
molekuli ühekordne annus tuleks manustada püsivas tasakaaluseisundis,
mis on saavutatud märgistamata ühendi manustamisel sihtlooma jaoks
kavandatud suurimale kogusele vastavas koguses.
4.2.7. Jääkide
biosaadavus
Teatavatest loomsetes saadustes sisalduvatest jääkidest
(seotud jääkidest) tarbijatele tulenevate ohtude hindamisel võib arvesse
võtta täiendavat turvalisuskoefitsienti, mis põhineb jääkide
biosaadavuse kindlaksmääramisel asjakohaste katseloomade ja tunnustatud
meetodite abil.
4.2.8. Muud toksikoloogilised ja farmakoloogilised
eriuuringud
Kui on alust muretsemiseks, tuleks teha täiendavad
uuringud, mis annavad kasulikku lisateavet toimeaine ja selle jääkide
ohutuse hindamiseks.
4.2.9. Täheldatava toimeta doosi (NOEL)
kindlaksmääramine
Täheldatava toimeta doosi (väljendatuna
mg-des kehamassi kg kohta päevas) kindlaksmääramisel tuleks arvesse
võtta kõiki eespool kirjeldatud leide ja kõiki asjakohaseid avaldatud
andmeid (sealhulgas asjakohast teavet toimeaine mõju kohta inimesele)
ning vajaduse korral teavet sarnaste keemiliste struktuuride kohta.
Valida tuleks madalaim täheldatava toimeta doos.
Aktsepteeritava
päevadoosi arvutamiseks kasutatav täheldatava toimeta doos tuleks
vastavalt olukorrale siiski valida toksikoloogilise või farmakoloogilise
mõju põhjal. Mõnede söödalisandite, nt antibakteriaalsete söödalisandite
puhul tuleks aktsepteeritav päevadoos kehtestada pigem inimese
soolestiku mikrofloorale avalduva mõju põhjal. Soolestiku mikrofloora
kirjeldamiseks rahvusvaheliselt tunnustatud ja kinnitatud meetodite
puudumise korral võib olla asjakohasem võtta aluseks valitud ja
tundlikele inimese soolestiku bakteriaalsetele tüvedele avalduv mõju.
4.3. Tarbijaohutuse hindamine
4.3.1. Ettepanek söödalisandi
aktsepteeritava päevadoosi (ADI) kohta
Vajaduse korral tuleb
teha ettepanek aktsepteeritava päevadoosi kohta. Aktsepteeritava
päevadoosi (väljendatuna söödalisandi või söödalisandiga seotud
materjali mg-des inimese kohta päevas) saamiseks jagatakse täheldatava
toimeta doos (mg-des kehamassi kg kohta) asjakohase
turvalisuskoefitsiendiga ja korrutatakse tulemus inimese keskmise
kehamassiga 60 kg. Kõnealuse täheldatava toimeta doosi, väljendatuna
mg-des kehamassi kg kohta päevas, võib valida toksikoloogiliste ja
farmakoloogiliste leidude põhjal. Mõnel juhul võib olla asjakohasem
määrata aktsepteeritav päevadoos kindlaks söödalisandi
mikrobioloogiliste omaduste põhjal. Valik sõltub sellest, milline omadus
on kõige asjakohasem tarbija tervisele tekkiva ohu seisukohast.
Konkreetse
söödalisandi aktsepteeritava päevadoosi kindlaksmääramiseks kasutatava
turvalisuskoefitsiendi valimisel tuleks arvesse võtta järgmist:
1)
täheldatava toimeta doosi kindlaksmääramiseks kasutatud bioloogilise
toime laad;
2) kõnealuse toime asjakohasus inimese jaoks ja toime
pöörduvus;
3) täheldatava toimeta doosi kindlaksmääramisel
kasutatud andmete valik ja usaldusväärsus;
4) teave jäägi
koostisosade toime kohta.
Tavaliselt kasutatakse aktsepteeritava
päevadoosi arvutamisel turvalisuskoefitsienti vähemalt 100 (s.o
koefitsient 10 liikidevahelise varieerumise võimaldamiseks ja
koefitsient 10 inimeste reaktsioonide varieerumise võimaldamiseks).
Madalam turvalisuskoefitsient võib olla vastuvõetav juhul, kui on olemas
andmed toimeaine mõju kohta inimestele.
4.3.2. Ettepanek
söödalisandi jääkide piirnormide kohta
Jääkide
piirnormi arvutamisel eeldatakse, et söödavate kudede ning piima- ja
munatoodete tarbimine on inimese ainus võimalik kokkupuuteallikas.
Vastasel korral tuleb arvesse võtta ka muid allikaid.
Mitmeid
kõnealuseid aineid on kasutatud nii söödalisandina kui ka muul
otstarbel. Sellistel juhtudel eeldatakse, et arvutatud jääkide
piirnormid on samad. Samuti võib esineda juhtusid, kus iga kasutusviisi
jaoks arvutatakse rangete teaduslike kaalutluste põhjal erinevad
piirnormid, kui manustamistee, manustatav kogus ning manustamise sagedus
ja kestus erinevad piisavalt vastavatest näitajatest söödalisandina
kasutamise korral, nii et on olemas tõendid selle kohta, et kineetika
või ainevahetuse tulemuseks võivad olla erinevad jääkide profiilid. Sel
juhul eeldatakse, et kohaldatakse rangeimat jääkide piirnormi.
Jääkide
piirnormi kehtestamiseks tuleb määratleda söödalisandist saadud ja
koejäägi piirnormi kindlaksmääramisel kasutatava aine keemilised
omadused. Seda ainet nimetatakse markerjäägiks. Kõnealune jäägikomponent
ei pea tingimata olema toksikoloogiliselt oluline jääk, kuid see tuleb
valida kui sobiv näitaja, mis iseloomustab kogu olulist jääki.
Markerjäägi ja kogujäägi suhe seoses aktsepteeritava päevadoosiga (st
markerjäägi ja radioaktiivsete jääkide suhe, markerjäägi ja kõikide
bioloogiliselt aktiivsete jääkide suhe) tuleks määrata kindlaks kõikidel
ajahetkedel jääkide kudedest kadumise uuringute käigus. Eelkõige peab
kõnealune suhe olema teada jääkide piirnormide kehtestamise aluseks
oleval hetkel. Samuti peab kõnealuse markerjäägi jaoks olema sobiv
analüüsimeetod, et tagada vastavus jääkide piirnormile.
Jääkide
piirnormide (väljendatuna markerjäägi g-des söödava märja koe või
saaduse kg kohta) kehtestamisel aktsepteeritava päevadoosi alusel tuleks
kohaldada järgmisi inimeste päevaseid toidutarbimise väärtusi:
| Imetajad | Linnud | Kalad | |
|
Lihaskude Maks Neer Rasvkude |
300 g
100 g 50 g 50 g2 |
300 g
100 g 10 g 90 g3 |
300 g1 |
|
+ Piim + Munad |
1500 g
|
100 g
|
|
|
1 Lihaskude ja nahk loomulikes proportsioonides |
|||
Eri kudede puhul kehtestatud jääkide piirnormid peaksid kajastama jääkide kadumise kineetikat sihtliikide kudedes. Tuleb kasutada analüüsimeetodit, mille kvantifitseerimispiir on madalam kui jääkide piirnorm (vt II jao punkt 2.5.3).
Kui aine võib tekitada jääke kudedes ja saadustes, tuleks jääkide piirnormid ette näha nii, et päevas tarbitavate toksikoloogiliselt (või mikrobioloogiliselt) oluliste jääkide üldkogus oleks väiksem kui aktsepteeritav päevadoos (vt eespool esitatud tabel).
Jääkide piirnorm tuleks kehtestada alles pärast seda, kui on arvesse võetud kõiki muid potentsiaalseid tarbija ja jäägikomponentide kokkupuute allikaid ja need allikad on kaasa arvatud.
Teatavate söödalisandite puhul võib jääkide sisaldus piimas, munades või lihas olla alla piirnormi, kuid mõjutada siiski toidu kvaliteeti teatavates töötlemisprotsessides, nt piima kasutamisel juustu valmistamiseks. Selliste söödalisandite puhul võib olla asjakohane kehtestada lisaks jääkide piirnormile ka «jääkide piirnorm toiduainete töötlemise korral».
Mõnedel juhtudel jääkide piirnormi ei nõuta, näiteks:
1) kui puudub jääkide biosaadavus ning kahjulik mõju inimese soolestikule ja selle mikrofloorale;
2) kui jäägid lagunevad sihtliikides täielikult toitaineteks või kahjututeks aineteks;
3) kui aktsepteeritavat päevadoosi ei ole kehtestatud loomkatsetes täheldatud madalast mürgisusest tulenevalt;
4) kui ainet kasutatakse üksnes lemmikloomade toidus;
5) kui aine on heaks kiidetud ka toidulisandina, ei nõuta tavaliselt jääkide piirnormi, kui markerjääk on peamiselt lähteaine ja moodustab üksnes ebaolulise osa toidulisandi aktsepteeritavast päevadoosist.
Soovitatav arvutus jääkide määramiseks: 500 g liha (sealhulgas 300 g lihaskudet, 100 g maksa, 50 g neeru, 50 g rasvkudet) või 500 g linnuliha (sealhulgas 300 g lihaskudet, 100 g maksa, 10 g neeru, 90 g rasvkudet) või 300 g kala) + 1500 g piima + 100 g muna.
4.3.3. Ettepanek söödalisandi keeluaja kohta
Keeluaeg määratakse kindlaks jääkide piirnormi alusel. Keeluaeg on ajavahemik söödalisandi kavandatud preparaadi manustamise lõpule järgnev ajavahemik, mis kulub selleks, et jäägikogused väheneksid alla piirnormide (usalduspiir 95%).
Keeluaja kehtestamiseks võib teatavat söödavat kudet käsitada muude kudede asendajana ja sageli nimetatakse seda sihtkoeks.
4.4. Töötaja ohutuse hindamine
Töötajad võivad söödalisandiga kokku puutuda peamiselt sissehingamise teel või paikse kontakti kaudu söödalisandi tootmisel, käitlemisel või kasutamisel, nt põllumajandusettevõtte töötajad võivad söödalisandiga kokku puutuda selle käitlemisel või segamisel. Tuleks esitada lisateavet ainete käitlemise kohta. Lisada tuleks töötajatele tekkiva riski hinnang.
Tootmisettevõttes saadud kogemused on sageli oluliseks teabeallikaks
nende riskide hindamisel, mis tekivad töötajate kokkupuutel
söödalisandiga õhu või paikse kontakti kaudu. Erilist tähelepanu nõuavad
kuiva pulbri kujul olevad või seda tekitavad söödalisandid,
söödalisandiga töödeldud söödad või loomade väljaheited ning võimalikku
allergiat tekitavad söödalisandid.
4.4.1. Toksikoloogilise
riski hindamine töötajate ohutuse seisukohast
4.4.1.1. Mõju
hingamiselundkonnale
Tuleks esitada tõendid selle kohta, et lenduv
tolmukogus ei kujuta endast ohtu töötajate tervisele. Need tõendid
peavad vajaduse korral hõlmama katseloomadega tehtud
sissehingamiskatseid, avaldatud epidemioloogilisi andmeid või taotleja
andmeid enda tootmisettevõttest või ärrituvuse ja hingamiselundkonna
sensibiliseerimise katseid.
4.4.1.2. Mõju silmadele ja nahale
Võimaluse
korral tuleks esitada teadaolevatest inimestega seotud olukordadest
saadud otsesed tõendid ärritava või sensibiliseeriva toime puudumise
kohta. Nendele tõenditele tuleks lisada tulemused, mis on saadud naha ja
silmade võimaliku ärrituse ja sensibiliseerimise uurimiseks asjaomase
söödalisandiga tehtud kinnitatud loomkatsetel.
4.4.1.3.
Süsteemne mürgisus
Töötajate ohutuse muude aspektide
hindamisel tuleks kasutada ohutusnõuete täitmiseks kogutud andmeid
mürgisuse kohta (sealhulgas kordusdoosi mürgisuse, mutageensuse,
kantserogeensuse ja paljunemisvõime katsed). Sealjuures tuleb meeles
pidada, et kõige tõenäolisemad kokkupuuteviisid on söödalisandi
sattumine nahale või sissehingamine.
4.4.2. Kokkupuute hindamine
Tuleks
esitada teave selle kohta, kuidas söödalisandi kasutamine võib
põhjustada mis tahes kokkupuudet: sissehingamist, nahale sattumist või
allaneelamist. See teave peaks võimaluse korral hõlmama kvantitatiivset
hinnangut, näiteks tüüpilist lenduvat kontsentratsiooni, nahakaudset
saastumist või allaneelamist. Kvantitatiivse teabe puudumise korral
tuleks esitada piisav teave, mis võimaldab kokkupuudet nõuetekohaselt
hinnata.
4.4.3. Kokkupuute piiramise meetmed
Kui kokkupuute
piiramiseks kohaldatakse konkreetsetel asjaoludel mõistlikke meetmeid,
tuleks toksikoloogia ja kokkupuute hinnangust saadud teabe põhjal teha
järeldus kasutaja tervist ohustavate riskide kohta (süsteemne mürgisus,
ärritus või sensibiliseerimine). Kui risk on vastuvõetamatu, tuleks
võtta kasutusele ettevaatusabinõud kokkupuute piiramiseks või
vältimiseks. Eelistatud lahenduseks on toote uuesti segamine või
tootmis-, kasutamis- või kõrvaldamisprotsesside muutmine. Kui
rakendatakse piiramismeetmeid, tuleks isiklike kaitsevahendite
kasutamist käsitada üksnes äärmusliku abinõuna jääkidest tulenevate
ohtude eest kaitsmisel.
4.5. Keskkonnaohu hindamine
Söödalisandite keskkonnamõju arvestamine on oluline, kuna söödalisandeid
manustatakse tavaliselt pika aja jooksul (isegi kogu elu jooksul),
hõlmatud võivad olla suured loomarühmad ning paljud söödalisandid
imenduvad halvasti ja seepärast väljutatakse need suures osas muutumata
kujul. Siiski võib keskkonnamõju hindamise vajadus olla paljudel
juhtudel piiratud. Rangete eeskirjade sätestamine käesolevas lisas ei
ole asjakohane. Söödalisandite keskkonnamõju kindlaksmääramise
hõlbustamiseks tuleks seda teha astmeliselt (vt otsustepuu), nii et
esimeses etapis on võimalik selgelt määrata need söödalisandid, mille
puhul edasisi katseid ei ole vaja. Muude söödalisandite puhul on
lisateabe saamiseks vaja uuringute teist etappi (etapp IIA) ning selle
teabe alusel võivad osutuda vajalikuks edasised uuringud (etapp IIB).
Kui uuringuid tehakse, tuleks need läbi viia vastavalt nõukogu
direktiivile 67/548/EMÜ.
4.5.1. Hindamine I etapis
I etapis
on hindamise eesmärk määrata kindlaks, kas söödalisandi või selle
metaboliitide märkimisväärne mõju keskkonnale on tõenäoline või mitte,
kasutades peamiselt muul otstarbel kogutud andmeid.
II etapi
hindamisest võib loobuda, kui on täidetud üks kahest järgmisest
kriteeriumist:
1) söödalisandi keemilistest omadustest,
bioloogilisest mõjust ja kasutusviisist nähtub, et mõju on tähtsusetu,
st kui söödalisand või selle peamised metaboliidid (üle 20% kogujäägist
väljaheites) on:
–füsioloogilised/looduslikud ained (nt
vitamiinid või mineraalained), mis ei muuda kontsentratsiooni
keskkonnas, välja arvatud juhul, kui on ilmselt alust muretsemiseks (nt
vase puhul);
–ette nähtud lemmikloomade jaoks (v.a hobused);
2)
halvim võimalik arvutussisaldus keskkonnas on liiga madal, et muret
tekitada.
Halvim võimalik arvutussisaldus mullas tekib tõenäoliselt
peamiste jäägi koostisosade (söödalisand või selle peamised
metaboliidid) maksimaalse väljutamise ajal tekkinud sõnniku maapinnale
laotamise tulemusel. Arvutussisaldust keskkonnas tuleks hinnata iga
peamise sõnnikus esineva jäägi koostisosa ja iga asjakohase
keskkonnakomponendi puhul. Maismaakomponendi puhul ei nõuta edasist
hindamist, kui arvutussisaldus keskkonnas ei ületa peamiste sõnnikus
esinevate jäägikomponentide summa puhul 100 µg/kg või kui peamised
sõnnikus esinevad jäägikomponendid lagunevad hõlpsasti (lagunemisaeg DT
50 30 päeva) (kui need andmed on kättesaadavad) looduslikeks
komponentideks või saavutavad kontsentratsiooni alla 100 µg/kg või kui
arvutussisaldus mullas (5 cm sügavusel) on väiksem kui 10 µg/kg.
Halvim
võimalik arvutussisaldus vees võib tekkida mahasattunud sööda või
söödalisandit ja selle metaboliite sisaldavate väljaheidete otsesel
kandumisel veekogudesse või väljaheidetes või mullas esineva materjali
leostumisel põhjavette. Kui veekogude või põhjavee saastumise puhul on
arvutussisaldus keskkonnas usaldusväärse hindamise alusel alla 0,1 µg
liitri kohta, ei ole veekomponendi puhul vaja IIA etapi hindamist
söödalisandi keskkonnamõju kindlakstegemiseks.
Kui
taotleja ei suuda tõendada kavandatud söödalisandi kuuluvust
kõnealustesse erandit võimaldavatesse kategooriatesse või kui
söödalisand viiakse otse keskkonda (nt akvakultuuri puhul), nõutakse
tavaliselt II etapi hindamist.
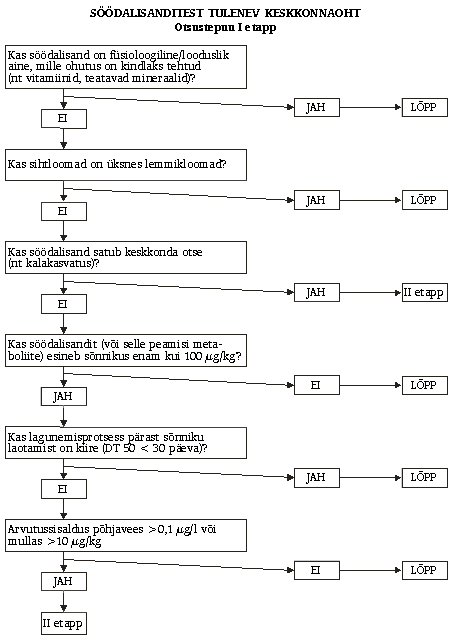
4.5.2. Hindamine II etapis
Hindamine II etapis jaguneb kaheks osaks:
etapp IIA ja etapp IIB.
Hinnata tuleks söödalisandi või selle
peamiste metaboliitide bioakumulatsiooni potentsiaali ja selle mõju
arvutuslikule ohutusvahemikule. Bioakumulatsiooni ei käsitata
potentsiaalselt olulisena juhul, kui nt Kow (jaotustegur) on
3. Asjakohaseid etapi IIB uuringuid on reeglina vaja juhul, kui
kõnealuseid ohutusvahemikke ei ole võimalik kindlaks määrata.
4.5.2.1.
Etapp IIA
Etapis IIA on hindamise eesmärgiks teha kindlaks
keskkonnaoht:
1) täpsustades keskkonnas esineva sisalduse
arvutusmeetodit;
2) määrates asjaomaste keskkonnakomponentide puhul
kindlaks seosed kokkupuute, söödalisandi või selle peamiste
metaboliitide ning asjaomaste asendusloomaliikide ja taimeliikide puhul
esineva lühiajalise kahjuliku mõju vahel;
3) kasutades
kõnealuseid tulemusi arvutusliku mittetoimiva sisalduse
kindlaksmääramiseks.
Ohu kindlaksmääramiseks soovitatakse
järgmist etapilist menetlust.
1) Kui seda ei ole juba tehtud I
etapis, tuleks iga asjaomase keskkonnakomponendi puhul arvutada täpsem
arvutussisaldus keskkonnas. Arvutussisalduse kindlaksmääramisel tuleks
arvesse võtta:
–söödalisandi või selle peamiste metaboliitide
kontsentratsiooni sõnnikus pärast söödalisandi kavandatud doosi
manustamist loomadele. Selle arvutuse puhul tuleks arvesse võtta
väljaheidete kogust ja doosi suurust;
–söödalisandiga seotud
väljutatud materjali potentsiaalset lahjenemist, mis tuleneb sõnniku
tavapärasest töötlemisest ja hoiustamisest enne laotamist;
–söödalisandi
ja selle metaboliitide adsorptsiooni või desorptsiooni mullas, jääkide
püsivust mullas (DT 50 ja DT 90); akvakultuuri puhul ladestumist;
–muid
tegureid, nagu fotolüüs, hüdrolüüs, aurumine, lagunemine mullas või
veesettes, kündmisest tingitud lahjenemine jne.
Nende arvutuste
tulemusel iga asjaomase keskkonnakomponendi puhul saadud
arvutussisalduse suurimat väärtust tuleks võtta arvesse riski hindamisel
etapis IIA.
Hindamist etapis IIB võib olla vaja juhul, kui püsivas
seisundis eeldatakse pikaajalist püsivust mullas (DT 90 > 1 aasta)
kontsentratsiooniga üle 10 g/kg.
2) Järgmisena tuleb kindlaks
määrata kogused, millel on tõsine lühiajaline kahjulik mõju toiduahela
eri astmetele asjaomaste keskkonnakomponentide (muld, vesi) puhul.
Katsete tegemisel tuleks järgida OECD suuniseid või samalaadseid
usaldusväärseid suuniseid. Maismaakeskkonna puhul sobivad järgmised
katsed: mürgisus vihmausside puhul (50% surmav kontsentratsioon, LC50
väärtus), fütotoksilisus maismaataimedes (50% toimet avaldav
kontsentratsioon, EC50 väärtus), mõju mulla
mikroorganismidele (nt EC50 metanogeneesile ja lämmastiku
sidumisele avalduva mõju puhul). Veekeskkonna puhul: kalad: 96-tunnine LC50
uuring; Daphnia magna: 48-tunnine EC50 uuring;
vetikad: LC50 uuring ja mürgisuse uuring setteorganismide
puhul.
3) Iga asjaomase keskkonnakomponendi puhul tuleks arvutada
arvutusliku mittetoimiva sisalduse väärtus. Kõnealuse väärtuse saamiseks
jagatakse tavaliselt eespool kirjeldatud ökotoksilisuse katsetes
registreeritud madalaim kahjuliku mõju väärtus (st kõige tundlikuma
liigi tulemus) turvalisuskoefitsiendiga vähemalt 100, sõltuvalt
kasutatud näitajast ja katseliikide arvust.
4) Saadud
arvutussisalduse ja arvutusliku mittetoimiva sisalduse väärtusi tuleks
võrrelda. Arvutussisalduse ja arvutusliku mittetoimiva sisalduse
väärtuste aktsepteeritav suhtarv sõltub arvutusliku mittetoimiva
sisalduse kindlaksmääramiseks kasutatud katsetulemusest. Harilikult on
see suhtarv 1 ja 0,1 vahel. Kui suhtarv osutub eespool märgitutest
oluliselt väiksemaks, ei ole tõenäoliselt vaja edasisi
ökotoksikoloogilisi teste, välja arvatud eeldatava bioakumulatsiooni
puhul. Vastupidiselt nõutakse suurema suhtarvu puhul etapi IIB katseid.
4.5.2.2.
Etapp IIB (üksikasjalikumad toksikoloogilised uuringud)
Kui
pärast hindamist etapis IIA säilib kahtlus söödalisandi keskkonnamõju
osas, tuleb teha üksikasjalikumad uuringud bioloogilistele liikidele
avalduva mõju kohta selles komponendis või nendes komponentides, kus
etapi IIA uuringud osutavad võimalikele probleemidele. Sellisel juhul on
vaja edasisi katseid, et teha kindlaks krooniline ja konkreetsem mõju
asjaomastele looma-, taime- ja mikroobiliikidele. Võib juhtuda, et
etapis IIA on arvutussisalduse väärtus hinnatud liiga suureks. Selle
tõendamiseks võib olla vaja mõõta söödalisandi või selle peamiste
metaboliitide sisaldust ja püsivust keskkonnas välikasutuse tingimustes.
Sobivaid
ökotoksikoloogilisuse lisakatseid on kirjeldatud mitmes väljaandes, nt
OECD suunistes. Võib osutuda vajalikuks uurida kolme keskkonnaliikide
kategooriat: loomi, taimi ja mikroorganisme. Kõnealused katsed tuleb
valida hoolikalt, et tagada nende vastavus söödalisandi või selle
metaboliitide võimaliku keskkonda viimise ja sattumise tingimustele.
Maismaakomponendile avalduva mõju hindamine võib hõlmata:
1)
subletaalse mõju uuringut vihmausside puhul, mulla mikrofloorale
avalduva mõju edasisi uuringuid, mitmete majanduslikult tähtsate
taimeliikide fütotoksilisuse uuringuid, rohumaadel elavate selgrootute,
sealhulgas putukate ja metslindude uuringuid;
2) mürgisust imetajate
suhtes ei ole vaja eraldi hinnata, kuna seda tehakse tõenäoliselt seoses
imetajate suhtes avalduva mürgisuse katsetega aktsepteeritava päevadoosi
kindlaksmääramiseks.
Veekomponendile avalduva mõju
hindamine võib hõlmata:
1) kroonilise mürgisuse uurimist
etapis IIA hindamise käigus kindlakstehtud kõige tundlikumate
veeorganismide puhul, nt noorte kalade uurimine mürgisuse suhtes,
paljunemiskatse vesikirpudel, 72tunnine katse vetikatega ning
bioakumulatsiooni uuring;
2) tõhusate leevendavate meetmete
kindlaksmääramist keskkonnamõju piiramise eesmärgil, kui ei suudeta
kindlaks teha piisavat ohutusvahemikku arvutussisalduse väärtuse ja
arvutusliku mittetoimiva sisalduse väärtuse vahel.
5. Monograafia vorm
5.1. Söödalisandi määratlus
5.1.1. Kavandatav
müüginimetus või -nimetused
5.1.2. Söödalisandi tüüp
selle põhifunktsiooni järgi. Toimeaine kõik muud kasutusviisid tuleb
täpsustada.
5.1.3. Kvalitatiivne ja kvantitatiivne koostis
(toimeaine, muud koostisained, lisandid, varieerumine partiide kaupa).
Kui toimeaine on aktiivsete koostisosade segu, tuleb kõiki selgelt
määratletavaid peamisi koostisosi kirjeldada eraldi ning märkida nende
osa segus.
5.1.4. Füüsikaline olek, osakeste jaotus suuruse järgi,
osakeste kuju, tihedus, puistetihedus; vedelike puhul: viskoossus,
pindpinevus.
5.1.5. Tootmisprotsess, sealhulgas spetsiifilised
töötlemismeetodid.
5.2. Toimeaine spetsifikatsioon
5.2.1. Üldnimetus, keemiline nimetus
IUPACi nomenklatuuri järgi, muud rahvusvahelised üldnimetused ja
lühendid. Chemical Abstracts Service’i number (CAS).
5.2.2.
Struktuurivalem, molekulivalem ja molekulmass. Kui toimeaine on
käärimissaadus, märkida peamiste koostisainete kvalitatiivne ja
kvantitatiivne koostis, mikroobne päritolu (kultuuride kogu nimi ja
asukoht, kus tüve säilitatakse).
5.2.3. Puhtus
Toimeaine
ning sellega kaasnevate lisandite ja mürgiste ainete kvalitatiivne ja
kvantitatiivne koostis, kinnitus tootmiseks kasutatavate organismide
puudumise kohta.
5.2.4. Põhiomadused
Keemiliselt määratletud
ainete füüsikalised omadused: dissotsiatsioonikonstant, pKa,
elektrostaatilised omadused, sulamispunkt, keemispunkt, tihedus,
aururõhk, lahustuvus vees ja orgaanilistes lahustites, Kow
ja Koc, massi- ja neeldumisspekter, NMRi andmed, võimalikud
isomeerid ja muud asjakohased füüsikalised omadused.
5.3. Söödalisandi füüsikalis-keemilised, tehnoloogilised ja
bioloogilised omadused
5.3.1. Söödalisandi püsivus kokkupuutel
selliste keskkonnatingimustega nagu valgus, temperatuur, pH, niiskus ja
hapnik. Eeldatav säilivusaeg.
5.3.2. Püsivus eelsegude ja
söötade valmistamise ajal, eelkõige eeldatavate töötlemistingimuste
suhtes (kuumus, niiskus, surve- ja nihkejõud ning aeg). Võimalikud
lagunemissaadused.
5.3.3. Püsivus eelsegude ja töödeldud söötade
ladustamise ajal ja kindlaksmääratud tingimustes. Eeldatav säilivusaeg.
5.3.4.
Muud asjakohased füüsikalis-keemilised, tehnoloogilised või
bioloogilised omadused, nt hajuvus soodsates tingimustes, mis on
asjakohased homogeensete segude moodustumisel ja püsimisel eelsegudes ja
söötades, tolmuteket takistavad ja elektrostaatilised omadused, hajuvus
vedelikes.
5.4. Kontrollimeetodid
5.4.1. Punktides 2.1.3, 2.1.4, 2.2.3, 2.2.4,
2.3.1, 2.3.2, 2.3.3 ja 2.3.4 loetletud kriteeriumide kindlaksmääramiseks
kasutatavate meetodite kirjeldus.
5.4.2. Sihtkudedes ja loomsetes
saadustes sisalduva toimeaine markerjäägi kindlaksmääramise
kvalitatiivsete ja kvantitatiivsete analüüsimeetodite kirjeldus.
5.4.3.
Kui kõnealused meetodid on avaldatud, piisab sellest, kui viidatakse
kirjandusele ning esitatakse vastavad kordustrükid.
5.4.4. Teave
võrdlusstandardite optimaalsete ladustamistingimuste kohta.
5.5. Söödalisandi bioloogilised omadused
5.5.1.
Koktsidiostaatikumide ja muude ravimite profülaktilise toime üksikasjad
(nt haigestumus, suremus, ootsüsti sisaldus ja kahjustuste ulatus).
5.5.2.
Zootehniliste söödalisandite, v.a punktis 5.5.1 loetletud lisandite
puhul teave söödakulule, eluskaalule, söödaväärindusele, saaduste
kvaliteedile ja saagisele ning muudele loomade, keskkonna, tootja või
tarbija jaoks soodsatele parameetritele avalduva mõju kohta.
5.5.3.
Tehnoloogiliste söödalisandite puhul asjakohane tehnoloogiline mõju.
5.5.4.
Kahjulik mõju, vastunäidustused või hoiatused (sihtlooma, tarbija,
keskkonna suhtes), sh bioloogiline vastasmõju, koos üksikasjalike
põhjendustega. Täpsustada tuleks kõik söödalisandi muude kasutusviiside
puhul kindlaksmääratud aktsepteeritavad päevadoosid või jääkide
piirnormid.
5.6. Kvantitatiivsed ja kvalitatiivsed andmed selliste võimalike jääkide kohta sihtkudedes, mis leiduvad loomsetes saadustes pärast söödalisandi kasutamist kavandatud viisil.
5.7. Vajaduse korral tuleks esitada aktsepteeritav päevadoos, kehtestatud jääkide piirnormid ja keeluajad.
5.8. Muud söödalisandi määratlemiseks asjakohased omadused
5.9. Kasutustingimused
5.10. Kuupäev
6. Märgistuslehe vorm
1. Söödalisandi määratlus
1.1. Söödalisandi tüüp
1.2.
Füüsikaline olek
1.3. Kvalitatiivne ja kvantitatiivne
koostis
1.4. Söödalisandi ja jääkide analüüsimeetod
1.5.
Ühenduse registreerimisnumber (EÜ number)
1.6. Pakend
2. Toimeaine spetsifikatsioon
2.1. Üldnimetus, keemiline
nimetus, CASi number
–Üldnimetus
–Keemiline nimetus
(IUPAC)
–CASi number
2.2. Empiiriline valem
3. Söödalisandi füüsikalis-keemilised, tehnoloogilised ja bioloogilised
omadused
3.1. Söödalisandi püsivus
3.2. Püsivus
eelsegude ja sööda valmistamise ajal
3.3. Püsivus eelsegude
ja sööda ladustamise ajal
3.4. Muud omadused
4. Kasutustingimused
4.1. Loomaliik või -rühm, maksimaalne vanus (kui
see on täpsustatud)
4.2. Minimaalne ja maksimaalne sisaldus
söödas
4.3. Vastunäidustused, vastasmõju
4.4.
Hoiatused
5. Ringlusse suunamise eest vastutav isik
5.1. Nimi
5.2. Aadress
5.3.
Registreerimisnumber
6. Valmistaja
6.1. Nimi
6.2. Aadress
6.3. Ettevõttele või
vahendajale määratud loa- või registreerimisnumber
7. Kuupäev
7. Loa uuendamine söödalisandi puhul, mille luba on antud söödalisandi ringlusse laskmise eest vastutavale isikule
1. Üldsätted
Loa uuendamiseks valmistab taotleja ette toimiku ja monograafia ning esitab loetelu kõikidest muudatustest, mis on tehtud pärast loa andmist ringlusse laskmiseks või pärast viimast loa uuendamist.
Tuleb kinnitada, et monograafiat ja ohutuskaarti on kohandatud, nii et need sisaldavad kogu uut teavet, mis on söödalisandi puhul asjakohane.
Samuti tuleb esitada teave, mis käsitleb lube maailmas tervikuna ja müügimahtu.
2. Toimeaine ja söödalisandi määratlus
Tuleks esitada tõendid selle kohta, et söödalisandit ega selle koostist, puhtust või toimet ei ole lubatud söödalisandiga võrreldes muudetud. Kõikidest tootmisprotsessi muudatustest tuleks teatada.
3. Efektiivsus
Tuleks esitada tõendid selle kohta, et söödalisand säilitab väidetava efektiivsuse Euroopa Liidus loa uuendamise taotlemise ajal valitsevates loomakasvatustingimustes. Need tõendid peaksid sisaldama söödalisandi kasutamise ja käitumise jälgimise käigus saadud üldiste kogemuste aruannet.
4. Mikrobioloogia
Erilist tähelepanu tuleks pöörata resistentsuse võimalikule tekkimisele mikroobivastaste ravimite suhtes pikaajalise kasutamise jooksul tegelikes kasutustingimustes. Seepärast tuleb katsed läbi viia välitingimustes põllumajandusettevõtetes, kus söödalisandit on kasutatud korrapäraselt võimalikult pika aja jooksul. Katseorganismidena tuleks kasutada tavapäraseid soolebaktereid ning bakterite valik peaks sisaldama asjakohaseid endogeenseid ja eksogeenseid grampositiivseid ja gramnegatiivseid organisme.
Kui katsete tulemused osutavad resistentsuse muutustele võrreldes esialgsete näitudega, tuleb uurida resistentsete bakterite ristresistentsust inimeste ja loomade nakkushaiguste raviks kasutatavate asjakohaste antibiootikumide suhtes. Kõige olulisemad on antibiootikumid, mis kuuluvad söödalisandiga samasse rühma, kuid katsed peaksid hõlmama ka muid antibiootikumide rühmi.
Esitada tuleks asjakohaste seireprogrammide tulemused.
5. Ohutus
Tuleks esitada tõendid selle kohta, et olemasolevaid teadmisi silmas
pidades on söödalisand heakskiidetud tingimustes jätkuvalt
sihtliikidele, tarbijatele, kasutajatele ja keskkonnale ohutu.
Söödalisandi ringlusse laskmiseks loa andmise või loa viimase uuendamise
järgse aja kohta tuleks esitada ohutusaruanne, milles esitatakse
järgmised punktid:
1) aruanded sihtloomadele, kasutajatele ja
keskkonnale avalduva kahjuliku mõju kohta, sh õnnetusjuhtumid (varem
tundmatu toime, tõsiste tagajärgedega toime, teadaoleva toime sagedasem
esinemine). Kahjuliku mõju aruanne peaks sisaldama toime laadi,
mõjutatud isikute/organismide arvu, tagajärgi, kasutustingimusi,
põhjuslikkuse hinnangut;
2) aruanded varem tundmatu vastasmõju
ja ristsaastumise kohta;
3) vajaduse korral jäägiseire andmed;
4)
muu teave söödalisandi ohutuse kohta.
Kui ühegi kõnealuse punkti kohta ei esitata lisateavet, tuleb seda selgelt põhjendada.
8. Uus taotleja, kelle taotlus tugineb esmakordsele loale söödalisandi puhul, mille luba on antud söödalisandi ringlusse laskmise eest vastutavale isikule
Kuna on võimalik tugineda esmakordsel loa taotlemisel esitatud andmete hindamisele, peab seoses taotlusega koostatav toimik vastama üksnes järgmistele tingimustele. Sel eesmärgil võib söödalisandit käsitada identsena, kui selle aktiivsete ja mitteaktiivsete koostisosade kvalitatiivne ja kvantitatiivne koostis ning puhtus on põhimõtteliselt samad, kui preparaat on sama ja kui kasutustingimused on identsed.
Selliste toodete puhul ei ole harilikult vaja korrata farmakoloogilisi, toksikoloogilisi ega efektiivsuse uuringuid ning võib esitada lühendatud taotluse. Kõnealune taotlus peab sisaldama ekspertide aruandeid.
Punktis 2 toodud andmed tuleb esitada täies mahus, samuti peab esitama monograafia.
Tuleb esitada andmed selle kohta, et söödalisandi füüsikalis-keemiliste omaduste spetsifikatsioon on põhimõtteliselt sama nagu juba lubatud toote puhul.
Tuleb kinnitada, et täiendavad teaduslikult põhjendatud teadmised söödalisandi kohta kättesaadavas kirjanduses ei ole muutnud esialgset efektiivsuse hinnangut pärast esialgse söödalisandi ringlusse laskmiseks loa saamist.
Erilist tähelepanu tuleks pöörata resistentsuse võimalikule tekkimisele mikroobivastaste ravimite suhtes söödalisandi pikaajalise kasutamise jooksul tegelikes kasutustingimustes. Seepärast tuleb katsed läbi viia välitingimustes põllumajandusettevõtetes, kus toimeainet on kasutatud korrapäraselt võimalikult pika aja jooksul. Katseorganismidena tuleks kasutada tavapäraseid soolebaktereid ning bakterite valik peaks sisaldama asjakohaseid endogeenseid ja eksogeenseid grampositiivseid ja gramnegatiivseid organisme.
Kui katsete tulemused osutavad resistentsuse muutustele võrreldes esialgsete näitudega, tuleb uurida resistentsete bakterite ristresistentsust inimeste ja loomade nakkushaiguste raviks kasutatavate asjakohaste antibiootikumide suhtes. Kõige olulisemad on antibiootikumid, mis kuuluvad söödalisandiga samasse rühma, kuid katsed peaksid hõlmama ka muid antibiootikumide rühmi.
Tuleks esitada tõendid selle kohta, et kättesaadavas kirjanduses esitatud olemasolevaid teaduslikke teadmisi silmas pidades on söödalisand heakskiidetud tingimustes jätkuvalt sihtliikidele, tarbijatele, kasutajatele ja keskkonnale ohutu.
Tuleb kindlaks teha keeluaja vastavus jääkide piirnormidele.
II. MIKROORGANISMIDE JA ENSÜÜMIDE KOHTA KOOSTATAVA TOIMIKU VORM
Üldosa
Söödalisandi nõuetekohasuse tõendamiseks selle turule toomise eesmärgil tuleb teha uuringud söödalisandi, selle kasutustingimuste, füüsikalis-keemiliste omaduste, määramismeetodite, tõhususe, söödalisandi toime kohta looma ainevahetuses ning bioloogiliste ja toksikoloogiliste mõjude kohta sihtliikidele. Nõuda võib kõiki käesolevas lisas kirjeldatud uuringuid ning vajaduse korral ka lisateavet.
Kui söödalisand on ette nähtud konkreetsesse liiki kuuluva loomarühma jaoks, viiakse need uuringud läbi selle sihtliigiga. Inimeste tervisele ja keskkonnale tekkiva ohu hindamiseks vajalikud uuringud sõltuvad peamiselt söödalisandi iseloomust ja selle kasutamise tingimustest. Selles suhtes ei kohaldata ranget reeglit.
Üksnes lemmikloomatoiduks ettenähtud söödalisandite puhul ei ole alati vaja läbida nii täielikku kroonilise mürgisuse, mutageensuse ja kantserogeensuse uuringute programmi kui selliste söödalisandite puhul, mis on ette nähtud eluskarjale, millest saadakse inimtoiduks ettenähtud tooteid. Kroonilise mürgisuse määramiseks piisab reeglina uuringutest kahe sihtliigiga või ühe sihtliigi ja rottidega ühe aasta jooksul.
Mutageneesi ja kantserogeneesi uuringutest võib üldiselt loobuda, kui keemiline koostis, praktilised kogemused või muud kaalutlused ei osuta muutuste võimalusele.
Lemmikloomade puhul võib loobuda jääkide analüüsist.
Käesolevas lisas ettenähtud andmete väljajätmisel toimikust tuleb esitada põhjendused. Trükised, millele toimikus on viidatud, tuleb sellele lisada.
Katsearuanded peavad sisaldama katse kava ja viitenumbrit, katsete algus- ja lõppkuupäeva, testide üksikasjalikku kirjeldust, tulemusi ja nende analüüsi ning uuringu eest vastutava isiku nime, aadressi ja allkirja. Iga loomkatsetes kasutatud söödapartii puhul tuleb sobiva meetodiga analüüsida asjaomaste toimeainete kontsentratsiooni ja esitada analüüsitulemuste aruanne. Aruandes tuleb samuti märkida iga katse käigus kindlakstehtud üksikannused, vastavad kuupäevad ning kontrolli eest vastutava isiku nimi, aadress ja allkiri. Aruandele tuleb samuti lisada katsed teinud labori/laborite koostatud sertifikaat selle kohta, et testid on tehtud kooskõlas hea laboritava põhimõtetega. Käesolevas lisas tähistatakse väljendiga «keemiliselt määratud ained» keemilisi aineid, mille keemiline nimetus on kokku lepitud IUPACi nomenklatuuri järgi.
Sisukord
1. Toimikus sisalduvate andmete kokkuvõte
2. Söödalisandi määratlus, omadused ja kasutustingimused ja kontrollimeetmed
3. Söödalisandi tõhususe uuringud
3.1. Söödalisandite
omaduste parandamise uuringud
3.2. Uuringud, mis käsitlevad
söödalisandite mõju loomsetele saadustele
3.3.
Loomsete saaduste kvaliteedi uuringud
4. Söödalisandi kasutamise ohutuse uuringud
4.1.
Sihtliikide uuringud
4.1.1. Söödalisandi toksikoloogilised uuringud
4.1.2.
Söödalisandi mikrobioloogilised uuringud
4.1.3.
Ainevahetuse ja jääkide uuringud
4.2. Eritistes esinevate
jääkide uuringud
4.3. Katseloomade uuringud
5. Monograafia vorm
1. Toimikus sisalduvate andmete kokkuvõte
2. Söödalisandi määratlus, omadused, kasutustingimused ja kontrollimeetodid
2.1. Söödalisandi määratlus
2.1.1. Kavandatav
müüginimetus või -nimetused.
2.1.2. Söödalisandi tüüp
selle põhifunktsiooni järgi.
2.1.3. Kvalitatiivne ja
kvantitatiivne koostis (toimeaine, muud koostisained, lisandid).
2.1.4.
Agregaatolek, osakeste suurus.
2.1.5. Tootmisprotsess, sh
spetsiifilised töötlemismeetodid
(Kui toimeaine on
aktiivsete koostisosade segu, tuleb kõiki selgelt määratletavaid peamisi
koostisosi kirjeldada eraldi ning märkida nende osa segus).
2.2. Toimeaine spetsifikatsioon
2.2.1. Keemiliselt määratud ainete
puhul: üldnimetus, keemiline nimetus IUPACi nomenklatuuri järgi, muud
rahvusvahelised üldnimetused ja lühendid. Chemical
Abstracts Service’i number (CAS).
Mikroorganismide puhul:
nimi ja taksonoomiline määratlus vastavalt rahvusvahelisele
nomenklatuuri eeskirjale. Kasutada võib ka rahvusvaheliselt tunnustatud
klassifitseerimise käsiraamatuid.
Ensüümpreparaatide puhul:
nimetus vastavalt Rahvusvahelise Biokeemia Liidu poolt kirjeldatud
peamisele ensümaatilisele aktiivsusele. EINECSi ja CASi number.
2.2.2.
Empiiriline ja struktuurivalem, molekulmass. Kui toimeaine on
käärimissaadus, märkida peamiste koostisosade kvalitatiivne ja
kvantitatiivne koostis.
Mikroorganismide puhul: rahvusvahelise
deponeerimisasutusena tunnustatud kultuuride kogu nimi ja koht
(võimaluse korral Euroopa Ühenduses), kus tüve säilitatakse,
registreerimisnumber, geneetiline modifikatsioon ja identifitseerimiseks
vajalikud tunnused. Peale selle päritolu, vastavad morfoloogilised ja
füsioloogilised omadused, arengustaadiumid, bioloogilist tegevust
(lisaainena) mõjutada võivad tegurid ja muud identifitseerimiseks
vajalikud geneetilised andmed. Kolooniaid moodustavate osakeste (CFU)
arv grammi kohta.
Ensüümpreparaatide puhul: bioloogiline päritolu
(mikroobse päritolu puhul): rahvusvahelise deponeerimisasutusena
tunnustatud kultuuride kogu nimi ja koht (võimaluse korral Euroopa
Ühenduses), kus tüve säilitatakse, registreerimisnumber, geneetiline
modifikatsioon ja identifitseerimiseks vajalikud tunnused, kaasa arvatud
geeniandmed), vastava keemiliselt puhta substraadi saamise viis ja muud
füüsikalised ja keemilised omadused.
Kõikidel juhtudel
tuleb esitada tõendi koopia mikroorganismide deponeerimise kohta
rahvusvahelises deponeerimisasutuses, tõendis täpsustatakse
mikroorganismi nimi ja taksonoomiline määratlus kooskõlas rahvusvahelise
nomenklatuuri eeskirjaga.
2.2.3. Puhtusaste
Prügilisandite
kvalitatiivne ja kvantitatiivne koostis.
Mikroorganismide puhul:
kasvatatud tüvede geneetiline stabiilsus ja puhtus.
Ensüümpreparaatide
puhul:
1) puhtus: kontrollitakse saastavate mikroorganismide ja
raskemetallide sisaldust ning sobiva meetodi abil demonstreeritakse
algorganismist saadud toksiinide (nt mükotoksiinid) puudumist;
2)
antimikroobse toime puudumine söödas kasutatava kontsentratsiooni puhul:
määratakse sobiva meetodi abil;
3) mitte-ensümaatiliste
osade koostis (eelkõige tahkete orgaaniliste ainete üldkogus TOS).
2.2.4.
Põhiomadused
Keemiliselt määratud ainete puhul:
elektrostaatilised omadused, sulamistemperatuur, keemistemperatuur,
lagunemistemperatuur, tihedus, aururõhk, lahustuvus vees ja
orgaanilistes lahustites, massi- ja neeldumisspekter ning muud
asjakohased füüsikalised omadused.
Mikroorganismide puhul:
identifitseerimise ja kavandatava kasutamisega seotud omadused (nt
vegetatiivne vorm või eosvorm, CFU arv grammi kohta).
Ensüümpreparaatide
puhul: optimaalsed pH-tasemed, temperatuurid ja muud asjakohased
omadused.
2.2.5. Tootmis- ja puhastamisprotsess ning kasutatud
keskkonnad
Partiide koostise muutumine tootmise käigus.
2.3. Söödalisandi füüsikalis-keemilised, tehnoloogilised ja
bioloogilised omadused
2.3.1. Püsivus (mikroorganismide puhul:
bioloogilise aktiivsuse kadumine, nt elujõulisus) kokkupuutel selliste
keskkonnatingimustega nagu valgus, temperatuur, pH, niiskus ja hapnik.
Säilivusaeg.
2.3.2. Püsivus (mikroorganismide puhul:
bioloogilise aktiivsuse kadumine, nt elujõulisus) eelsegude ja söötade
valmistamise ajal, eelkõige kokkupuutel kuumuse, rõhu ja niiskusega.
Võimalikud lagunemissaadused.
2.3.3. Püsivus (mikroorganismide
puhul: bioloogilise aktiivsuse kadumine, nt elujõulisus) eelsegude ja
söötade ladustamise ajal, kindlaksmääratud tingimustes. Säilivusaeg.
Ensüümpreparaatide
puhul: üksikasjad selliste ootamatute reaktsioonisaaduste esinemise
kohta, mis on tekkinud ensüümpreparaatide ensümaatilisel või keemilisel
reageerimisel söödakomponentidega või ensüümpreparaadi lagunemisel sööda
ladustamise ajal.
2.3.4. Muud asjakohased füüsikalis-keemilised,
tehnoloogilised või bioloogilised omadused nagu eeldus homogeensete
segude saamiseks eelsegudes ja söötades, tolmutekitavad omadused ning
mikroorganismide või ensüümpreparaatide puhul hinnang vastupidavuse
kohta lagunemisel ja bioloogilise aktiivsuse kadumise kohta seedetraktis
või in vitro simulatsioonimudeliga.
2.3.5.
Füüsikalis-keemiline või bioloogiline vastasmõju või kokkusobimatus (nt
söötade, teiste heakskiidetud söödalisandite või ravimitega).
2.4. Söödalisandi kasutustingimused
2.4.1. Kavandatav
kasutus loomasöötades (nt asjaomane loomaliik ja -rühm, sööda liik,
manustamisperiood, keeluaeg).
2.4.2. Vastunäidustused
2.4.3.
Kavandatav doseerimine eelsegudes ja söötades, väljendatuna:
1)
toimeaine massiprotsentides eelsegude puhul ja mg/kg sööda puhul, kui
tegemist on keemiliselt määratud ainetega,
2) sobivates
bioloogilise aktiivsuse ühikutes (nt kolooniaid moodustavate osakeste
arv toote grammi kohta) mikroorganismide puhul või asjakohastes
aktiivsusühikutes ensüümpreparaatide puhul.
2.4.4.
Muud toimeaine või preparaadi teadaolevad kasutused (toidus, meditsiinis
või veterinaarias, põllumajanduses ja tööstuses). Iga kasutuse puhul
märkida müüginimetus, näidustused ja vastunäidustused.
2.4.5.
Vajaduse korral märkida meetmed ohu vältimiseks ning kaitsevahendid
tootmise ja käitlemise ajaks.
2.5. Kontrollimeetodid
2.5.1. Punktides 2.1.3, 2.2.3, 2.2.4, 2.2.5,
2.3.1, 2.3.2, 2.3.3, 2.3.4 ja 2.4.3 loetletud kriteeriumide määramiseks
kasutatavate meetodite kirjeldus.
2.5.2. Selliste kvalitatiivsete ja
kvantitatiivsete analüüsimeetodite kirjeldus, mida kasutatakse
söödalisandi tavapäraseks kontrollimiseks eelsegudes ja söötades.
2.5.3.
Selliste kvalitatiivsete ja kvantitatiivsete analüüsimeetodite
kirjeldus, mida kasutatakse söödalisandi jääkide määramiseks loomsetes
toodetes.
Kõnealuste meetodite kirjeldustele ja saadud tulemustele
tuleb lisada teave, mis käsitleb usaldusnivood, spetsiifilisust,
tundlikkust, avastamispiire, teiste ainete võimalikku mõju,
reprodutseeritavust ja kasutatud proovivõtumeetodit. Valmistise ja
toimeaine standardid peavad olema kättesaadavad.
Mikroorganismide
puhul märgitakse avastamis-, loendus- ja identifitseerimismeetodid ja
vastavad märgistusained.
3. Söödalisandi tõhususe uuringud
3.1. Söötade omaduste parandamise uuringud
Kõnealused uuringud käsitlevad tehnoloogilisi lisandeid, nt antioksüdandid, säilitusained, sideained, emulgaatorid, stabilisaatorid, želeerivad ained jms, mis on ette nähtud eelsegude ja söötade omaduste parandamiseks või stabiliseerimiseks. Mõnesid mikroorganisme või ensüümpreparaate võib söötade vastavate omaduste parandamise korral käsitada tehnoloogiliste lisaainetena.
Söödalisandi tõhusust tuleks demonstreerida kavandatud kasutustingimustes asjakohaste kriteeriumide abil, võrreldes asjaomast söödalisandit negatiivsete kontrollsöötadega ja võimaluse korral söötadega, mis sisaldavad teadaoleva mõjuga tehnoloogilisi lisandeid.
Iga katse puhul täpsustatakse uuritavate toimeainete, preparaatide, eelsegude ja söötade täpne iseloom, partiide viitenumber, toimeainete sisaldus eelsegudes ja söötades, katsetingimused (nt temperatuur ja niiskus), samuti katsete kuupäev ja kestus ning katse ajal ilmnenud kahjulik ja negatiivne mõju.
3.2. Uuringud söödalisandite mõju kohta loomakasvatustoodangule
Käesolevad uuringud käsitlevad zootehnilisi söödalisandeid, mis
mõjutavad loomakasvatustoodangut. Järgmised uuringud, kaasa arvatud
doosi ja toime suhte uuring, tuleks teha iga sihtliigiga, võrrelduna
negatiivsete kontrollrühmadega ning võimaluse korral rühmadega, kes
saavad teadaoleva mõjuga söödalisandeid sisaldavat sööta. Kui toimeaine
on aktiivsete koostisosade segu, peab iga koostisosa esinemine olema
õigustatud.
3.2.1. Koktsidiostaatikumide ja muude ravimite puhul
tuleks eriti tähelepanu pöörata spetsiifiliste mõjude tõendamisele,
eelkõige profülaktilistele omadustele (nt haigestumus, ootsüsti sisaldus
ja kahjustuste ulatus). Lisada võib teabe söödalisandi mõjude kohta
söödaväärindusele, loomade kasvule ning loomsete saaduste
kaubanduslikule kogusele ja kvaliteedile.
3.2.2. Teiste zootehniliste
söödalisandite puhul (sealhulgas vajaduse korral mikroorganismide või
ensüümpreparaatide puhul) tuleks esitada teave söödalisandi mõju kohta
söödaväärindusele, loomade kasvule, loomsete saaduste omadustele ja
kogusele, loomade heaolule ja teistele parameetritele, mis mõjuvad
positiivselt loomakasvatustoodangule.
3.2.3. Katsetingimused
Tehtavaid
katseid tuleb kirjeldada ja tulemused esitada ükshaaval ning
üksikasjalikult. Tuleb esitada statistilise analüüsi aruanne ja märkida
kasutatud meetodid. Esitada tuleb järgmised andmed:
3.2.3.1.
Loomade liik, tõug, vanus ja sugu ning kindlakstegemise kord.
3.2.3.2.
Katse- ja kontrollrühmade arv, loomade arv igas rühmas. Kummastki soost
loomade arv peab olema statistika jaoks piisav.
3.2.3.3.
Kontrollanalüüsi abil sobiva tunnustatud meetodiga määratud toimeaine
(ja vajaduse korral võrdlusainete) kontsentratsioon söödas. Partiide
viitenumber. Ratsiooni kvalitatiivne ja kvantitatiivne koostis
toiteväärtuse aspektist.
3.2.3.4. Iga katse tegemise koht.
Loomade tervislik ja füsioloogiline seisund ning söötmis- ja
pidamistingimused kooskõlas tavapäraselt ühenduses kasutatavate
tingimustega. Sööda kontrollimine ning meetmed, mis on võetud
kontrollrühmade saastumise vältimiseks katse ajal (eelkõige
mikroorganismide põhjustatud sööda ristsaastumise vältimiseks).
3.2.3.5.
Katsete kuupäev ja täpne kestus. Tehtud uuringute kuupäevad ja laad.
3.2.3.6.
Katsete ajal ilmnenud kahjulikud ja muud negatiivsed mõjud ning nende
ilmnemise aeg.
3.3. Loomsete saaduste kvaliteedi uuringud
Sellistelt loomadelt saadud toodete organoleptilised omadused, toiteväärtus, hügieeni- ja tehnoloogilised omadused, keda söödetakse uuritavat söödalisandit sisaldava söödaga.
4. Söödalisandi kasutamisohutuse uuringud
Käesolevas jaos kirjeldatud uuringud on ette nähtud selleks, et hinnata:
1)
söödalisandi kasutamise ohutust sihtliikides;
2)
sissehingamisest või muul kokkupuutel limaskesta, silma või nahaga
tekkivaid ohte isikutele, kes tõenäoliselt käitlevad söödalisandit
algolekus või eelsegude või söötade koostisosana;
3)
tarbijale tekkivaid ohte, mis võivad tuleneda asjaomase söödalisandi
jääke või metaboliite sisaldava toidu tarbimisest;
4)
keskkonna reostamise või keskkonnas püsimise ohte, mis tulenevad
otseselt asjaomasest söödalisandist või sellest tuletatud ja loomade
poolt väljutatud saadustest;
5) võimalikke ohte muudele
loomaliikidele kui sihtliikidele.
Kõnealuseid uuringuid nõutakse täielikult või osaliselt, sõltuvalt söödalisandi iseloomust ja selle kavandatavatest kasutustingimustest.
Üldjuhul peavad mikroorganismid või ensüümpreparaadid olema mikroorganismid, mis ei ole kavandatavatel kasutustingimustel sihtliikide ja inimeste jaoks patogeensed ega toksigeensed, või pärinema sellistest mikroorganismidest.
Mikroorganismide või ensüümpreparaatide puhul tuleb teha asjakohased ohutustestid, välja arvatud juhul, kui esitatakse küllaldased dokumendid kasutamisohutuse kohta. Mikroorganismide puhul tuleb teha vähemalt sihtliigi taluvustest.
Üldjuhul ei nõuta loomade või taimede söödavatest osadest saadud ensüümide toksikoloogilist testi; kui selliseid saadusi ei käsitata üldjuhul tavalise toiduvaliku osana, võib nõuda toksikoloogilisi teste.
Keemiliselt määratud toimeainete korral on oluline tunda toimeaine ainevahetust mitmes sihtliigis ning samuti koejääkide koostist ja biosaadavust, et määrata kindlaks katseloomadega tehtavate uuringute maht tarbijale tekkiva ohu hindamiseks. Lisaks sellele on hädavajalik tunda asjaomasest söödalisandist tekkinud väljutatud jääkide koostist ning füüsikalis-keemilisi ja bioloogilisi omadusi, et määrata kindlaks selliste uuringute maht, mis on vajalikud, et hinnata keskkonnareostuse ohtu ja söödalisandi püsivust keskkonnas.
4.1. Sihtliikide uuringud
4.1.1. Söödalisandi toksikoloogilised
uuringud
Taluvustestid
Bioloogiliste, toksikoloogiliste,
makroskoopiliste ja histoloogiliste mõjude uuring. Kindlusvaru (suurima
kavandatud doosi ja kahjulikke mõjusid tekitava sisalduse vahe)
kindlaksmääramine. Piisab kõnealuse varu vähima või ligikaudse väärtuse
esitamisest, kui näidatakse, et kahjulikke mõjusid tekitav sisaldus on
tunduvalt suurem suurimast kavandatud doosist.
4.1.2. Söödalisandi
mikrobioloogilised uuringud
4.1.2.1. Kui toimeaine on keemiliselt
määratud ja söödas esineva kontsentratsiooni juures antimikroobse
toimega, tuleb teha söödalisandi antibakteriaalse mõjuala uuringud,
milleks määratakse väikseim bakterite kasvu pärssiv kontsentratsioon
mitmete patogeensete ja mittepatogeensete gramnegatiivsete ja
grampositiivsete bakterite puhul.
4.1.2.2. Ristresistentsuse uuringud
ravimantibiootikumide suhtes, milleks määratakse väikseim bakterite
kasvu pärssiv kontsentratsioon selliste mutantide puhul, kes on toodetud in
vitro ning kes on asjaomase söödalisandi suhtes
kromosoomresistentsed. Ravimantibiootikumide suhtes resistentsete
mikroorganismide puhul tuleks ära näidata kõnealuse resistentsuse
geneetiline baas.
4.1.2.3. Testid, millega selgitatakse, kas
söödalisand on võimeline põhjustama resistentsusfaktorite selektsiooni.
Need testid tehakse tavatingimustes loomaliikidega, kellele söödalisand
on eelkõige mõeldud. Seejärel tuleks määrata, kas leitud
resistentsusfaktorid kannavad multiresistentsust ning on edasikantavad.
4.1.2.4.
Testid, millega määratakse kindlaks söödalisandi mõju:
1)
seedetrakti mikrofloorale;
2) seedetrakti kolonisatsioonile, kui
tegemist on mikroorganismi või mitme mikroorganismi tüve seguga;
3)
patogeensete mikroobide levikule või väljutamisele, kui toimeaine on
keemiliselt määratud ja antimikroobse toimega.
4.1.2.5. Kui
toimeaine on antimikroobse toimega, tuleks teha väliuuringud
söödalisandi suhtes resistentsete bakterite protsendi kontrollimiseks.
Need uuringud tuleb läbi viia pikemate ajavahemike järel enne ja (üks
kuu) pärast söödalisandi kasutamist ning selle kasutamise ajal.
4.1.2.6.
Kui toimeaine on mikroorganism, tuleks kontrollida, kas see on
antibiootikumide suhtes resistentne.
4.1.2.7. Kui toimeainet (nt
ensüümpreparaate) toodab mikroorganism, tuleks määrata vastava
elujõulise organismi sisaldus.
4.1.2.8. Kui söödalisand sisaldab
EL Nõukogu direktiivi 90/220/EMÜ geneetiliselt muundatud organismide
keskkonda viimise kohta (EÜT L 106, 17.04.2001, lk 1–39) artikli 2
lõigetes 1 ja 2 määratletud geneetiliselt muundatud organismi või
koosneb sellistest organismidest, tuleb esitada järgmine teave:
1)
koopia pädeva asutuse kirjalikust nõusolekust või kirjalikest
nõusolekutest geneetiliselt muundatud organismide tahtliku keskkonda
viimise kohta uurimis- ja arenduseesmärkidel vastavalt direktiivi
90/220/EMÜ artikli 6 lõikele 4 ning direktiivi 90/220/EMÜ artiklis 9
osutatud taotluse kokkuvõte vastavalt EL Nõukogu otsuses 91/596/EMÜ
geneetiliselt muundatud organismide keskkonda viimise kohta (EÜT L 322,
23.11.1991, lk 1–16) esitatud näidisele;
2) täielik
tehniline toimik direktiivi 90/220/EMÜ II lisas nõutava teabega, mida on
vajaduse korral täiendatud, et võtta arvesse söödalisandi kasutuskohtade
erinevust, sealhulgas teave andmete ja tulemuste kohta, mis on saadud
uurimis- ja arendustöö eesmärgil keskkonda viimisest ning mis käsitleb
ökosüsteeme, mida söödalisandi kasutamine võib mõjutada, samuti tootes
sisalduvate GMOde või GMO kombinatsioonidega seotud ning inimeste ja
loomade tervist ning keskkonda ähvardavate ohtude hinnang, sealhulgas
uurimis- ja arendustöö etapil saadud teave keskkonda viimise mõju kohta
inimeste tervisele ja keskkonnale;
3) söödalisandi turuleviimise
tingimused, sealhulgas kasutamise ja käitlemise eritingimused ning
märgistamise ja pakendamise soovitused, mis vastavad vähemalt direktiivi
90/220/EMÜ III lisas ettenähtud nõuetele.
Kui toimiku
eest vastutav isik leiab, tuginedes direktiivi 90/220/EMÜ B-osa kohaselt
taotletud keskkonda viimise tulemustele või kaalukatele teaduslikult
põhjendatud argumentidele, et söödalisandi turuleviimine või kasutamine
ei kujuta endast ohtu inimeste ja loomade tervisele ega keskkonnale,
võib ta taotleda enda vabastamist III lisa B-osa ühe või mitme nõude
järgimisest.
Lisada tuleb teave andmete või tulemuste kohta, mis
toimiku eest vastutav isik on saanud samade GMOde või GMO
kombinatsioonide keskkonda viimisel kas ühenduses või väljaspool
ühendust või mille keskkonda viimist ta taotleb või on varem taotlenud.
Samuti
võib viidata andmetele või tulemustele, mida varem on oma taotlustes
esitanud teised isikud, juhul kui nad on andnud selleks kirjaliku
nõusoleku.
4.1.3. Toimeaine ainevahetuse ja jääkide uuringud,
kui toimeaine on keemiliselt määratud. Punktides 4.1.3.1, 4.1.3.3 ja
4.1.3.4 nimetatud uuringud tuleks läbi viia märgistatud molekulidega või
teiste sobivate meetoditega, igal üksikjuhul tuleb kasutatud meetodi
valikut põhjendada. Märgistus peaks olema vastavuses kavandatava
eesmärgiga. Kui toimeaine on käärimissaadus, peaksid kõnealused uuringud
hõlmama ka tootmisprotsessis saadud kõrvalsaadusi.
4.1.3.1.
Ainevahetuse uuringud:
1) ainevahetuse tasakaal: toimeaine imendumise
ja väljutamise kiirus ja määr;
2) ainevahetusradade ja
peamiste metaboliitide kindlakstegemine;
3) metaboliitide jaotumine
ja eritumine (sapi-, kuse-, roojaeritus);
4) vajaduse korral
soolestiku või mao mikrofloora, enterohepaatilise tsirkulatsiooni või
tsekotroofia mõju ainevahetusele.
4.1.3.2. Jääkide analüüsivad
uuringud: jääkide (toimeaine, metaboliidid) kvalitatiivne ja
kvantitatiivne koostis erinevates loomse päritoluga toiduainetes
ainevahetuse tasakaalu korral ja söödalisandi tegelikes
kasutustingimustes.
4.1.3.3. Jääkide kineetiline analüüs (pärast
söödalisandi korduvat manustamist vastavalt kavandatud kasutusele):
toimeaine ja peamiste metaboliitide püsivus organites ja kudedes pärast
söödalisandiga sööda andmise lõpetamist.
4.1.3.4.
Loomse päritoluga toiduainetes sisalduvate jääkide biosaadavuse uuring.
4.1.3.5.
Järelevalvemeetodid: punktides 4.1.3.1–4.1.3.4 märgitud uuringutes
kasutatavad kvalitatiivsed ja kvantitatiivsed määramismeetodid ning
teave usaldusnivoo, spetsiifilisuse ja avastamispiiride kohta. Jääkide
määramismeetodid peavad olema piisavalt tundlikud, et jääke oleks
võimalik avastada väga madalatel toksikoloogilistel tasemetel.
4.2. Väljaheidetes esinevate jääkide uuring (kui toimeaine on
keemiliselt määratud)
4.2.1. Söödalisandist tekkinud
jääkide (toimeaine, metaboliidid) iseloom ja kontsentratsioon
väljaheidetes.
4.2.2. Kõnealuste lägas, sõnnikus ja allapanus
leiduvate jääkide püsivus (poolestusaeg) ja kadumise kiirus.
4.2.3.
Mõju metanogeneesile.
4.2.4. Lagunemine, püsivus (poolestusaeg)
ja kadumise kiirus pinnases (võrrelda eri mullatüüpe).
4.2.5.
Mõju mullafaunale ja mikroobide transformatsiooniprotsessile (nt
taimsete ja loomsete jääkide lagunemine).
4.2.6. Mõju
maismaataimedele (nt seemnete idanemine, taimekasv, taimede toitumine).
Need uuringud tuleks läbi viia kontrollitavates tingimustes ja
välitingimustes, kasutades eri taimeliike.
4.2.7. Söödalisandist
tekkinud saaduste (toimeaine, metaboliidid) lahustuvus ja püsivus vees.
4.2.8.
Mõju veeorganismidele
4.2.8.1. Mõju taimestikule (nt Chlorella).
4.2.8.2.
Mürgine toime selgrootutele (nt Daphnia magna).
4.2.8.3.
Mürgine toime kaladele (vähemalt kaks ühenduse territooriumil looduses
esinevat liiki).
4.3. Katseloomade uuringud
Need uuringud tuleb teha toimeaine ja selle peamiste metaboliitide või muude saadustega, kui neid leidub samuti söödavates loomsetes saadustes ning kui need on bioloogiliselt saadaval. Võimaluse korral tuleks üritada valida katseloomad, kelle puhul on söödalisandi seedimine ja ainevahetus eeldatavalt sarnane inimese vastavatele funktsioonidele.
Tehtud testide kohta tuleb esitada täielik üksikasjalik kirjeldus.
Kirjelduses tuleks märkida kasutatavad loomaliigid ja -tõud, katse- ja
kontrollrühmade suurus ja arv, manustatud dooside tase, toidusedeli
koostis ja söödaanalüüside tulemused, pidamistingimused, testide täpne
kestus, uuringute tegemise kuupäevad ning suremus. Esitada tuleb
makroskoopiliste patoloogiliste ja histopatoloogiliste leidude
üksikasjad kõikide testitud loomade puhul ning patoloogiliste
kahjustuste ilmnemise aeg. Kõik tulemused, sh statistiline hinnang,
tuleb esitada üksikasjalikult.
4.3.1. Äge mürgisus
(mikroorganismide puhul ei uurita)
4.3.1.1. Ägeda suukaudse mürgisuse
uuringud tuleb läbi viia kahe loomaliigiga (soovitatavalt peaks üks liik
olema rott). Maksimaalne doos ei tohiks olla üle 2.000 mg eluskaalu kg
kohta. Üksikasjalikult tuleks registreerida kõik märkused bioloogiliste
mõjude kohta, mis ilmnevad vähemalt sissevõtmisele järgneva kahe nädala
jooksul. Neid uuringuid ei tehta ensüümpreparaatide puhul.
4.3.1.2.
Söödalisandi käitlemisega seotud võimalike ohtude hindamiseks tuleks
sobivate testide abil teha uuringud sissehingamisel tekkiva ägeda
mürgistuse, naha- ja vajaduse korral limaskestaärrituste ja allergeense
potentsiaali suhtes.
4.3.2. Mutageensus
4.3.2.1. Keemiliselt
määratud toimeaine puhul
Mutageensete omadustega
toimeainete või nende metaboliitide või muude saaduste
kindlakstegemiseks tuleb teha valitud hulk mutageensuse teste, mis
põhinevad geneetilise toime avaldumise eri faasidel. Metaboolseks
aktiveerimiseks tuleb testid teha imetajate mikrosoomi preparaadi
juuresolekul ja ilma selleta.
Soovitatakse järgmisi teste:
1)
geenmutatsioonide test prokarüootses süsteemis;
2)
geenmutatsioonide test in vitro eukarüootses süsteemis või sooga
aheldatud retsessiivsete letaalsete mutatsioonide katse Drosophila
melanogaster’is;
3) kromosoomaberratsiooni test in vitro
ja in vivo.
Eespool pakutud saritest ei tähenda, et muud
testid oleksid sobimatud või et muid teste, eelkõige in vivo
teste ei võiks alternatiividena kasutada.
Kõikidel juhtudel
tuleb esitada testide valiku põhjendused. Testid tuleb teha kehtestatud
ja tunnustatud meetodite kohaselt. Sõltuvalt testide tulemustest ning
võttes arvesse aine kogu toksilisust ja kavandatavat kasutusala, võib
teha täiendavaid uuringuid.
4.3.2.2. Mikroorganismidest saadud
ensüümpreparaatide puhul nõutakse tavaliselt järgmiseid teste:
1)
geenmutatsioonide test bakterites;
2) kromosoomaberratsiooni test
(eelistatult in vitro).
Toksikoloogilised testid tehakse
võimaluse korral lõplikult puhastatud käärimissaadusest võetud partiiga
enne tugiainete, lahjendusvedelike või teiste ainete lisamist. Testid
tuleks üldjuhul teha vastavalt tunnustatud rahvusvaheliste asutuste
kehtestatud suunistele, kuid rakutasandil võib teatavate
ensüümpreparaatide valgulise iseloomu või ensümaatilise aktiivsuse tõttu
olla vaja muuta standardseid katseprotokolle, eelkõige in vitro
testide puhul. Sellised erandid on lubatud, kui esitatakse piisavad
põhjendused.
Katsesüsteemi eesmärk on määratlemata toksiliste
reaktsioonide ja genotoksilise mõju avastamine. Üldomadustest ja
käesolevast saritestist saadava teabe põhjal on võimalik hinnata nii
kindlate, hästi tuntud toksiinide kui ka tundmatute toksiliste ühendite
esinemist tootes.
Toksikoloogiline aruanne peab sisaldama küllaldasi
dokumente selle kohta, et testid on tehtud materjaliga, mis on
tehnilises toimikus kirjeldatud kaubandusliku toote aluseks.
4.3.3.
Farmakokineetika
Kui toimeaine on keemiliselt määratud, tuleb
tasakaalu uuringutes ja metaboliitide kindlakstegemisel kasutada
sobivaid märgistatud molekule või teisi sobivaid tehnikaid ning
kõnealused uuringud peaksid hõlmama toimeaine dooside nii ühe- kui
mitmekordset manustamist sobivate ajavahemike järel. Ainevahetuse
uuringud peavad hõlmama ka toimeaine ja peamiste metaboliitide
farmakokineetika uurimist. Täiendavateks toksikoloogilisteks uuringuteks
sobivaimate liikide valikul tuleks tähelepanu pöörata toimeaine
erinevale ainevahetusele eri liikides.
4.3.4. Subkrooniline mürgisus
Need
uuringud tuleb üldreeglina läbi viia kahe loomaliigiga (soovitatavalt
peaks üks liik olema rott). Mõnedel juhtudel võib teine loomaliik olla
sihtliik. Testitavat ainet võib manustada suu kaudu ning tuleb kindlaks
määrata doosi ja sellele reageerimise suhe. Uuringu pikkus näriliste
puhul peab olema vähemalt 90 päeva.
Teatavatel juhtudel on
soovitatav teha kuue kuu kuni kahe aasta pikkused uuringud
mittenärilistega, et teha kindlaks eri loomaliikide tundlikkuse
varieerumine testitava aine suhtes.
Neid uuringuid ei tehta
mikroorganismide puhul. Mikroorganismidest saadud ensüümpreparaatide
puhul võib närilistega tehtud 90-päevane oraalse toksilisuse test olla
piisav.
4.3.5. Krooniline mürgisus/kantserogeensus
Kroonilise
mürgisuse uuringud tuleb läbi viia ühe loomaliigiga (soovitatavalt
rottidega), kantserogeensuse uuringud soovitatavalt kahe liigi
närilistega. Aine tuleb manustada suu kaudu mitme doositasemega. Lubatud
on ka kombineeritud mürgisuse/kantserogeensuse üsasisene uuring. Katsed
peaksid kestma vähemalt 24 kuud rottide puhul ja 18 kuud hiirte puhul.
Miinimumaja ületamise korral tuleb katse lõpetada, kui muudes gruppides
peale kõrgeima doositasemega grupi on ellujäämisprotsent langenud 20
protsendini.
Kogu katse vältel tuleb asjakohaste ajavahemike järel
teha täielikud kliinilise keemia, vere ja uriini uuringud. Kõikide katse
ajal surnud loomadega ja katse lõppemisel elusolevate loomadega tuleb
teha täielikud makroskoopilised ja histoloogilised uuringud.
Neid
uuringuid ei tehta mikroorganismide ega ensüümpreparaatide puhul.
4.3.6.
Paljunemisvõimet kahjustav toksilisus (kui toimeaine on keemiliselt
määratud)
Paljunemisvõimet käsitlevad uuringud tuleb
soovitavalt teha rottidega. Uuringud peavad hõlmama vähemalt kahte
järjestikust põlvkonda ning uuringuid võib kombineerida
embrüotoksilisuse, sh teratogeensuse uuringutega. Tähelepanelikult
tuleks jälgida kõiki asjakohaseid viljakuse, tiinuse, sünnieelse ja
-järgse aja parameetreid ning need registreerida. Vähemalt kahe sobiva
loomaliigiga tuleb teha spetsiifilised teratogeensuse uuringud.
4.3.7.
Metaboliitide toksikoloogia (kui toimeaine on keemiliselt määratud)
Inimestele
tekkiva ohu hindamise aluseks peab olema teave jääkide kontsentratsiooni
arvutamise kohta. Kavandatava keeluaja arvutamise aluseks olevad andmed
peavad olema kättesaadavad. Punktis 4.1.3.4 mainitud uuringud tuleb teha
katseloomadega.
4.3.8. Muud asjakohased uuringud
Esitada võib
täiendavaid eriuuringuid, mis annavad kasulikku lisateavet testitava
aine hindamiseks (nt biosaadavus, neurotoksilisus, immuuntoksilisus).
5. Monograafia vorm
5.1. Söödalisandi määratlus
5.1.1. Kavandatav
müüginimetus või -nimetused
5.1.2. Söödalisandi liik
selle põhifunktsiooni järgi
5.1.3. Kvalitatiivne ja
kvantitatiivne koostis (toimeaine, muud koostisained, lisandid)
5.1.4.
Agregaatolek, osakeste suurus
5.1.5. Võimalik spetsiifiline töötlus
Kui
toimeaine on aktiivsete koostisosade segu, peavad kõik koostisosad olema
selgelt määratletavad ning peamisi koostisosi tuleb kirjeldada eraldi ja
märkida nende osa segus.
5.2. Toimeaine spetsifikatsioon
5.2.1. Keemiliselt määratud ainete
puhul: üldnimetus, keemiline nimetus IUPACi nomenklatuuri järgi, muud
rahvusvahelised üldnimetused ja lühendid. Chemical
Abstracts Service’i number (CAS).
Mikroorganismide puhul:
nimi ja taksonoomiline määratlus vastavalt rahvusvahelisele
nomenklatuuri eeskirjale. Kasutada võib ka teisi rahvusvaheliselt
tunnustatud klassifitseerimise käsiraamatuid.
Ensüümpreparaatide
puhul: nimetus vastavalt Rahvusvahelise Biokeemia Liidu kirjeldatud
peamisele ensümaatilisele aktiivsusele, EINECSi ja CASi number.
5.2.2.
Empiiriline ja struktuurivalem, molekulmass. Kui toimeaine on
käärimissaadus, märkida peamiste koostisosade kvalitatiivne ja
kvantitatiivne koostis.
Mikroorganismide puhul: rahvusvahelise
deponeerimisasutusena tunnustatud kultuuride kogu nimi ja koht
(võimaluse korral Euroopa Ühenduses), kus tüve säilitatakse,
registreerimisnumber, geneetiline modifikatsioon ja identifitseerimiseks
vajalikud tunnused.
Ensüümpreparaatide puhul: bioloogiline päritolu
(mikroobse päritolu puhul: rahvusvahelise deponeerimisasutusena
tunnustatud kultuuride kogu nimi ja koht (võimaluse korral Euroopa
Ühenduses), kus tüve säilitatakse, registreerimisnumber, geneetiline
modifikatsioon ja identifitseerimiseks vajalikud tunnused, kaasa arvatud
geneetilised andmed), vastava keemiliselt puhta substraadi saamise viis
ja muud füüsikalised ja keemilised omadused.
5.2.3.
Puhtusaste
Prügilisandite kvalitatiivne ja kvantitatiivne koostis
Mikroorganismide
puhul: kasvatatud tüvede püsivus ja puhtus.
Ensüümpreparaatide
puhul:
1) puhtus; selleks kontrollitakse saastavate mikroorganismide
ja raskmetallide sisaldust ning demonstreeritakse sobiva meetodi abil
algorganismist saadud toksiinide (nt mükotoksiinide) puudumist;
2)
antimikroobse toime puudumine sööda kontsentratsiooni tasemel, määratuna
sobiva meetodi abil;
3) mitte-ensümaatiliste osade koostis (eelkõige
tahkete orgaaniliste ainete üldkogus TOS).
5.2.4. Põhiomadused
Keemiliselt
määratud ainete puhul: elektrostaatilised omadused, sulamistemperatuur,
keemistemperatuur, lagunemistemperatuur, tihedus, aururõhk, lahustuvus
vees ja orgaanilistes lahustites, massi- ja neeldumisspekter ning muud
asjakohased füüsikalised omadused.
Mikroorganismide puhul:
identifitseerimiseks ja kavandatavaks kasutamiseks vajalikud tunnused
(nt vegetatiivne vorm või eosvorm, CFU arv grammi kohta).
Ensüümpreparaatide
puhul: optimaalsed pH-tasemed, temperatuurid ja muud asjakohased
omadused.
5.3. Söödalisandi füüsikalis-keemilised, tehnoloogilised ja
bioloogilised omadused
5.3.1. Püsivus (mikroorganismide puhul:
bioloogilise aktiivsuse kadumine, nt elujõulisus) kokkupuutel selliste
keskkonnatingimustega nagu valgus, temperatuur, pH, niiskus ja hapnik.
Säilivusaeg.
5.3.2. Püsivus (mikroorganismide puhul:
bioloogilise aktiivsuse kadumine, nt elujõulisus) eelsegude ja söötade
valmistamise ajal, eelkõige kokkupuutel kuumuse, rõhu ja niiskusega.
Võimalikud lagunemissaadused.
5.3.3. Püsivus (mikroorganismide
puhul: bioloogilise aktiivsuse kadumine, nt elujõulisus) eelsegude ja
sööda ladustamise ajal, kindlaksmääratud tingimustes. Säilivusaeg.
5.3.4.
Muud asjakohased füüsikalis-keemilised, tehnoloogilised või
bioloogilised omadused nagu eeldus homogeensete segude saamiseks
eelsegudes ja söötades, tolmutekitavad omadused ning mikroorganismide
või ensüümpreparaatide puhul hinnang vastupidavuse kohta lagunemisel ja
bioloogilise aktiivsuse kadumise kohta seedetraktis või in vitro
simulatsioonimudeliga.
5.3.5. Füüsikalis-keemiline või bioloogiline
vastasmõju või kokkusobimatus (nt söötade, teiste heakskiidetud
söödalisandite või ravimitega).
5.4. Kontrollimeetodid
5.4.1. Käesoleva jao punktides 5.1.3, 5.2.3,
5.2.4, 5.3.1, 5.3.2, 5.3.3 ja 5.3.4 loetletud kriteeriumide määramiseks
kasutatavate meetodite kirjeldus.
5.4.2. Selliste kvalitatiivsete ja
kvantitatiivsete analüüsimeetodite kirjeldus, mida kasutatakse
söödalisandi jääkide määramiseks loomsetes toodetes.
5.4.3.
Kui kõnealused meetodid on avaldatud, piisab sellest, kui viidatakse
kirjandusele ning esitatakse vastavad kordustrükid.
5.5. Söödalisandi bioloogilised omadused
5.5.1.
Koktsidiostaatikumide ja muude ravimite profülaktilise toime üksikasjad
(nt haigestumus, ootsüsti sisaldus ja kahjustuste ulatus).
5.5.2.
Punktiga 5.1 hõlmamata zootehniliste söödalisandite puhul, sealhulgas
vajaduse korral mikroorganismide või ensüümpreparaatide puhul: teave
söödalisandi mõju kohta söödaväärindusele, loomade kasvule, loomsete
saaduste omadustele ja kogusele, loomade heaolule ja teistele
parameetritele, mis mõjuvad positiivselt loomakasvatustoodangule.
5.5.3.
Vastunäidustused või hoiatused, sealhulgas bioloogiline sobimatus, ning
nende põhjendatuse üksikasjad.
5.6. Kvantitatiivsed ja kvalitatiivsed üksikasjad võimalike jääkide kohta, mis leiduvad loomsetes saadustes pärast söödalisandi kasutamist kavandatud viisil.
5.7. Muud söödalisandi määratlemiseks sobivad omadused.
| Kantsler Ants NOOT |
|
Põllumajandusministri 25. jaanuari 2005. a määruse
nr 8 «Söödalisandi loa taotlus ning uue erisöödamaterjali tootmise
ja erisöödamaterjali uue kasutamisviisi taotlus ning taotluse
menetlemise kord» lisa 4 |
ERISÖÖDAMATERJALI TOIMIKU VORM
Üldosa
Erisöödamaterjali toimikute abil peab olema võimalik hinnata toodet olemasolevate teadmiste alusel ning toimikus esitatud andmed peavad tõendama, et toode vastab selle kasutamise lubamiseks esitatud nõuetele.
Toimikus peab esitama kogu teabe, mis on vajalik mikroorganismi ja söötme koostise kindlakstegemiseks; samuti andmed toote tootmisprotsessi, omaduste, esitlemise, kasutamistingimuste, määramismeetodite ja toiteomaduste kohta. Esitama peab ka teabe, mis võimaldab hinnata, kuidas taluvad toodet sihtliigid ning samuti teabe toote kasutamisest inimesele või keskkonnale tuleneva otsese või kaudse ohu kohta.
Toimik peab sisaldama üksikasjalikke aruandeid, mis esitatakse käesolevas lisas toodud järjestuses ning millega peab kaasas olema kokkuvõte. Nõutud uuringute puudumist peab põhjendama. Kui toimikus on viidatud trükistes sisalduvatele andmetele, tuleb sellised trükised toimikule lisada.
Sisukord
I. Mikroorganism, sööde ja tootmisprotsess, toote omadused, esitlemine ja kasutamistingimused, määramismeetodid
II. Toote toiteomaduste uurimine
III. Toote loomasöödas kasutamise bioloogiliste tagajärgede uuringud
IV. Muud asjakohased uuringud
I. MIKROORGANISM, SÖÖDE JA TOOTMISPROTSESS, TOOTE OMADUSED, ESITLEMINE JA KASUTAMISTINGIMUSED, MÄÄRAMISMEETODID
1. Mikroorganism
1.1. Klassifikatsioon, päritolu, morfoloogia, bioloogilised omadused, geneetiline manipulatsioon.
1.2. Ohutus, ellujäämisvõimalused väljaspool kääritajat ja võimalikud mõjud keskkonnale.
1.3. Kasvatatud tüvede püsivus ja puhtus. Kõnealuste kriteeriumide kontrollimiseks kasutatavad meetodid.
2. Sööde ja tootmisprotsess
2.1. Substraadi koostis, lisaained jms.
2.2. Tootmis-, kuivatamis- ja puhastamisprotsess. Mikroobide surmamine. Kultuuri koostise püsivuse kontrollimise meetodid ja keemilise, füüsikalise ja bioloogilise saastumise avastamine tootmise ajal.
2.3. Kasutamiseks ettevalmistamise tehniline protsess.
3. Toote omadused
3.1. Füüsikalised ning füüsikalis-keemilised omadused: makro- ja mikromorfoloogia, osakese suurus, tihedus, erikaal, hügroskoopsus, lahustuvus, elektrostaatilised omadused jms.
3.2. Keemiline koostis ja keemilised omadused.
3.2.1. Niiskuse-,
toorvalgu-, toorrasva-, toortselluloosi-, toortuha- ja
süsivesikutesisaldus. Kõnealuste koostisosade sisalduse lubatud
kõikumine.
3.2.2. Üldammooniumi, amiidide, nitraatide ja
nitritite, nukleiinhapete ning valkude sisaldus. Üld- ja vabade
aminohapete ning puriin- ja pürimidiinaluste kvalitatiivne ja
kvantitatiivne koostis.
3.2.3. Üldlipiidide kvalitatiivne ja
kvantitatiivne koostis: rasvhapped, seebistumatud ained, lipiidides
lahustuvad pigmendid, fosfolipiidid.
3.2.4. Süsivesikute fraktsiooni
koostis.
3.2.5. Anorgaaniliste koostisosade kvalitatiivne ja
kvantitatiivne koostis.
3.2.6. Vitamiinide kvalitatiivne ja
kvantitatiivne koostis.
3.2.7. Muude koostisosade kvalitatiivne ja
kvantitatiivne koostis: söödalisandid, substraadi ja lahustite jäägid,
muud võimalikud substraadi ainevahetuse, söötme või tootmisprotsessi
kahjulikud jäägid.
3.3. Toote mikrobioloogiline saastumine.
3.4. Toote toime ja stabiilsus algolekus ja ladustamise ajal segatuna tavaliselt kasutatavate söötadega.
4. Esitus ja kasutamistingimused
4.1. Toote turustamiseks kavandatavad nimed.
4.2. Kavandatavad toote turustamisviisid.
4.3. Toote kavandatav kasutus loomasöödas. Kavandatavad kontsentratsioonid täissöötades ja kavandatavad kogused asjaomase loomaliigi igapäevastes söödakogustes.
5. Määramismeetodid
Kvalitatiivsed ja kvantitatiivsed meetodid toote määramiseks täis- ja täiendsöötades. Selliste meetodite kirjeldusele tuleb lisada teave, mis käsitleb spetsiifilisust, tundlikkust, avastamispiire, vea ülemmäärasid ja teiste ainete võimalikku mõju. Kättesaadavad peaksid olema erinevate kavandatud kontsentratsioonidega tootenäidised.
II. TOOTE TOITEOMADUSTE UURIMINE
1. Valgu väärtuse hindamine
1.1. Keemilised, biokeemilised ja mikrobioloogilised uuringud.
1.2. Uuringud katseloomadega, võrrelduna võrdlusvalkudega.
2. Sihtliikide uuringud
Järgnevad uuringud tuleb teha iga sihtliigiga ning tulemusi võrrelda kontrollgrupiga, kes samades toitumistingimustes saavad tavapäraselt kasutatavat sööta, mis sisaldab samaväärses koguses valgulist lämmastikku (mäletsejaliste puhul üldlämmastikku).
2.1. Päevastes söödakogustes sisalduv toote valgu väärtus ja energia lisaväärtus kavandatavate kasutustingimuste puhul eri füsioloogilistes etappides (nt kasvuperiood, tiinus, munemine).
2.2. Toote mõju kasvule, söödaväärindusele, haigestumusele ja suremusele kavandatavate kasutustingimuste puhul.
2.3. Toote optimaalne kogus toiduratsioonis toitumuslikust seisukohast.
2.4. Toote mõju loomse päritoluga toiduainete tehnoloogilistele, organoleptilistele ja muudele omadustele kavandatavate kasutustingimuste puhul.
3. Katsetingimused katseloomade uurimisel
Esitada tuleb tehtud katsete üksikasjalik kirjeldus ja järgmised andmed:
3.1. Loomade liik, tõug, vanus ja sugu ning kindlakstegemise kord.
3.2. Katse- ja kontrollrühmade arv; loomade arv igas rühmas (arv peaks olema piisavalt suur sobivate statistiliste parameetritega tehtava statistilise analüüsi jaoks).
3.3. Toote sisaldus, toiduratsiooni kvalitatiivne ja kvantitatiivne koostis ning ratsiooni analüüs.
3.4. Iga katse tegemise koht, füsioloogiline seisund ja veterinaarnõuded, samuti pidamistingimused (kajastatakse tegelikult kasutatavaid tingimusi).
3.5. Katsete täpne kestus ja tehtud analüüside kuupäevad.
3.6. Katsete ajal ilmnenud kahjulikud mõjud ja nende ilmnemise aeg.
III. TOOTE LOOMASÖÖDAS KASUTAMISE BIOLOOGILISTE TAGAJÄRGEDE UURINGUD
1. Sihtliikide uuringud
Järgnevad uuringud peab tegema iga sihtliigiga ning tulemusi võrdlema kontrollgrupiga, kes samades toitumistingimustes saavad tavapäraselt kasutatavat sööta, mis sisaldab samaväärses koguses valgulist lämmastikku (mäletsejaliste puhul üldlämmastikku):
1.1. Toote maksimaalne sisaldus päevases toiduratsioonis, mille puhul ei ilmne kahjulikke mõjusid.
1.2. Vajaduse korral toote võimalik mõju viljakusele ja paljunemisele.
1.3. Toote manustamise mõju seedetrakti mikrofloorale ja patogeeniasustusele kavandatavate kasutustingimuste puhul.
1.4. Loomse päritoluga toiduainetes leiduvate toote võimalike jääkide (substraat, sööde, lahustid, saasteained) uurimine kavandatavate kasutustingimuste puhul.
1.5. Väljaheidetes leiduvate toote võimalike jääkide (substraat, sööde, lahustid, saasteained) uurimine kavandatavate kasutustingimuste puhul.
2. Katseloomade uuringud
2.1. Ainevahetus
Toote kulgemine loomas: absorptsioon, akumulatsioon, biotransformatsioon ja väljutamine.
2.2. Mutageensus
Võimaliku saasteainetest (eelkõige mükotoksiinidest ja bakteritest) või tootejääkidest (substraadist, söötmest, lahustitest) tuleneva mutageensuse uurimine, sealhulgas in vitro lausteimimine metaboolsete aktiveerimissüsteemide abil.
2.3. Toksikoloogilised uuringud
Uuringud tuleb teha võrdluses kontrollgrupiga, kes samades
toitumistingimustes saavad tavapäraselt kasutatavat sööta, mis sisaldab
samaväärses koguses valgulist lämmastikku. Uurima peab toksilisi
mõjusid, et selgitada nende põhjust ja põhimõtteid ning teha kindlaks,
et mõjud ei tulene toitumusliku tasakaalu puudumisest või toote
üledoseerimisest toidus.
2.3.1. Subkrooniline mürgisus (vähemalt
90 päeva): uuringud tuleb läbi viia kahe loomaliigiga, kellest üks on
näriline. Toodet tuleb päevase söödakogusega anda vähemalt kahes
sisalduses. Sisaldused tuleb valida nii, et võimaluse korral saaks
määrata toksilist taset, mille puhul mõju puudub, ning taset, mille
puhul ilmneb teatav kahjulik mõju. Loomarühmades peab olema piisav arv
kummastki soost isendeid. Alati peab olema ka kontrollrühm. Uuringud
tuleb läbi viia väikese hulga katserühma loomadega (rühm on põhirühmast
eraldi ja sõltumatu) sobivate ajavahemike järel kogu katse vältel ning
elusolevate loomadega katse lõpul. Sobivate ajavahemike järel tuleb
registreerida kõik asjakohased bioloogilised andmed, eelkõige kasvu
kiirus, sööda omastamine, hematoloogia, uriinianalüüsid, biokeemilised
parameetrid, suremus, organite kaal ning põhiorganite ja -kudede kogu
patoloogia ning histopatoloogia. Tulemused tuleb esitada üksikasjalikult
ning võimaluse korral tuleb lisada statistiline hinnang.
2.3.2.
Krooniline mürgisus: uuringud tuleb läbi viia kahe loomaliigiga, kellest
üks on näriline. Toodet tuleb päevase söödakogusega anda vähemalt kahes
sisalduses. Katsed peavad kestma vähemalt kaks aastat rottide puhul ja
80 nädalat hiirte puhul. Loomarühmades peab olema piisav arv kummastki
soost isendeid. Alati peab olema ka kontrollrühm.
2.3.3.
Kantserogeensus: hindamisel tuleb eelkõige tähele panna kasvajate
tekkimise aega, nende histoloogilist tüüpi ja esinemissagedust. Mis
tahes mõju kasvajate või haiguste esinemissagedusele või kulule tuleb
hinnata võrdluses kontrollrühmaga vastavalt punktile 2.3. Tulemused
tuleb esitada üksikasjalikult ning võimaluse korral tuleb lisada
statistiline hinnang.
2.4. Muud uuringud
Sigimist käsitlevad uuringud peavad hõlmama vähemalt kahte järjestikust põlvkonda ning uuringuid võib kombineerida embrüotoksilisuse, sealhulgas teratogeensuse uuringutega. Tähelepanu tuleb pöörata viljakusele, sigivusele ja pesakondade sünnijärgse arengu jälgimisele. Võib kasutada mõnda teist meetodit, mis on teaduslikult põhjendatud ning millega saadakse mõõdetavad tulemused (nt edasikanduva mürgisuse uuringud).
2.5. Katsetingimused katseloomade uurimisel
Esitada tuleb tehtud katsete üksikasjalik kirjeldus ja järgmised andmed:
2.5.1.
Loomade liik, tõug, liin ja sugu.
2.5.2. Katse- ja
kontrollrühmade arv, loomade arv igas rühmas (arv peaks olema piisavalt
suur sobivate statistiliste parameetritega tehtava statistilise analüüsi
jaoks).
2.5.3. Toote sisaldus, toiduratsiooni kvalitatiivne ja
kvantitatiivne koostis ning ratsiooni analüüs.
2.5.4.
Üldised pidamistingimused katseperioodil.
2.5.5. Katsete täpne
kestus ja tehtud uuringute kuupäevad.
2.5.6. Erinevate
katserühmade suremus ja surmade aeg.
2.5.7. Katsete ajal
ilmnenud kliinilised haigusnähud ja patoloogilised muutused ning nende
ilmnemise aeg.
3. Keskkonnauuringud
Sihtliigi väljaheidetes leiduvate võimalike tootejääkide (substraat, sööde, lahustid, saasteained) laadist sõltuvalt võib nõuda andmeid kõnealuste jääkide kulgemise kohta sõnnikus, pinnases ja vees, samuti nende mõju kohta pinnase bioloogiale, taime kasvule ja veeorganismidele.
IV. MUUD ASJAKOHASED UURINGUD
Sõltuvalt toote laadist ja kasutustingimustest võib nõuda andmeid allergilise toime kohta ning nahka ja silma, hingamisteede või seedetrakti limaskesti ärritava toime kohta, et hinnata ning vältida võimalikke ohte toote käitlemisel.
| Kantsler Ants NOOT |
 Facebook
Facebook Twitter
Twitter